
【题目】室温时,向试管中通入气体X(如图),下列实验中预测的现象与实际不相符的是
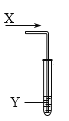
选项 | 气体X | 试管中的物质Y | 预测现象 |
A | 乙烯 | Br2的CCl4溶液 | 溶液橙色逐渐褪去,最终液体分为上下两层 |
B | SO2 | 品红溶液 | 溶液红色逐渐褪去 |
C | 甲烷 | 酸性KMnO4溶液 | 无明显现象,溶液紫色不褪 |
D | 氯气 | FeCl2溶液(浅绿色) | 溶液由浅绿色逐渐变为黄色 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本有机化工原料。由A制备重要中间体G路线(部分反应条件略去)如下所示:

已知:(1)
回答下列问题:
(1)B的电子式_________,C中含有的官能团的名称是______________。
(2)反应(1)和(4)的反应类型分别是_____________,_____________。
(3)反应(2)的反应条件是____________。
(4)已知G的分子式为C8H12O3,其结构简式为_______________。
(5)写出反应(3)的化学反应方程式_________________________________。
(6)X与C互为同系物且比C多一个碳,则X有___种结构(已知双键连羟基不稳定不考虑)
(7)参照上述合成路线,设计一条由乙炔和丙酮为起始原料制备2-甲基-1,3丁二烯的合成路线__________。书写格式如图: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 在A1C13溶液中逐滴滴入NaOH溶 液至过量,然后通入CO2气体 | 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 | Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中 |
B | 向浓度均为0.1mol/L的MgCl2、 CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO 3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃分子可看成由—CH3、—CH2—、![]() 和
和![]() 等结合而成的。试写出同时满足下列条件的烷烃的结构简式:___________ ,此烷烃可由烯烃加成得到,则该烯烃可能有___________种。
等结合而成的。试写出同时满足下列条件的烷烃的结构简式:___________ ,此烷烃可由烯烃加成得到,则该烯烃可能有___________种。
① 分子中同时存在上述4种基团;② 分子中所含碳原子数最少;
③ 该烷烃的一氯代物同分异构体的数目最少。
(2)碳原子数为8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有_______种。
(3)已知烯烃通过臭氧氧化并经锌和水处理得到醛或酮。例如:
 CH3CH2CHO+
CH3CH2CHO+
上述反应可用来推断烃分子中碳碳双键的位置。
某烃A的分子式为C6H10,经过上述转化生成![]() ,则烃A的结构可表示为_______________。
,则烃A的结构可表示为_______________。
(4) 请写出 物质与足量的金属钠发生反应的化学方程式_________。
物质与足量的金属钠发生反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锶(Sr3N2)在工业上有广泛的应用,某学习兴趣小组拟设计以下两套实验方案制备氮化锶。已知:锶与氮气在加热条件下反应产生氮化锶,氮化锶遇水剧烈反应产生氢氧化锶和氨气。方案Ⅰ:根据下列装置制备氮化锶。

回答下列问题:
(1)Sr在元素周期表中的位置是____________________
(2)写出A装置中饱和氯化铵溶液和NaNO2溶液反应的化学方程式__________________________
(3)按气流方向,写出装置的连接顺序为___________(装置可重复使用,填字母表示)。
(4)实验时先点燃_____处酒精灯(填“A”或“B”),一段时间后,点燃另一只酒精灯。

方案Ⅱ:某氮气样品可能含有少量的CO、CO2、O2等气体杂质,某同学设计如下装置制备氮化锶(各装置盛装足量试剂)。已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
(5)试管Ⅲ盛装的试剂是_____________________(写试剂的名称)。
(6)测定产品纯度:取Xg产品,向其中加入适量的水。将产生的气体全部通入到浓硫酸中,浓硫酸增重mg,则产品纯度为______(用代数式表示)。
(7)有同学认为上述方法使测得产品纯度偏高,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。
(1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com