
| c(OH-) |
| c(B+) |
| A、c(H+)<c(OH-)<c(B+)<c(A-) |
| B、c(OH-)<c(H+)<c(B+)<c(A-) |
| C、c(A-)=c(B+)>c(H+)=c(OH-) |
| D、c(H+)+c(B+)=c(OH-)+c(A-) |
| c(OH-) |
| c(B+) |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:

| 甲 | 乙 |
| 0.10mol H2O | 0.20mol H2 |
| 0.10mol CO | 0.20mol CO2 |
c(
| ||
| c(OH).c(HN3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置,过滤海带灰浸取液 装置,过滤海带灰浸取液 |
B、 装置,在滤液中通入Cl2 装置,在滤液中通入Cl2 |
C、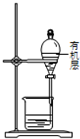 装置,先放出下层液体,再从下口放出有机层 装置,先放出下层液体,再从下口放出有机层 |
D、 装置,回收萃取剂苯并获得单质碘 装置,回收萃取剂苯并获得单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都是常用的干燥剂 |
| B、常温下都能与氢前金属反应放出氢气 |
| C、一定条件下和铜反应中都表现出强氧化性和强酸性 |
| D、分别露置在空气中,容器内溶质的物质的量浓度都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全时的pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com