
| A | B | C | D | E | F |
 |
 |
 |
 |
 |
 |
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 |
2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体. |
| 褪色时间 | 31秒 | 4秒 |
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.8 | 1.0 | 0.2 |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.2 |
| 1 |
| c(CH3OH) |
| c(CO)c2(H2) |
| 0.2 |
| 0.8×12 |
| 0.6mol |
| 2L |
| 0.8mol |
| 2L |
| 1 |
| 1.1×12 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、K(HF)=7.2×10-4 |
| B、K(HCN)<K(HNO2)<K(HF) |
| C、根据①③两个反应即可知三种酸的相对强弱,相同条件下HCN的酸性最弱 |
| D、相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇(乙酸):生石灰,过滤 |
| B、苯(苯酚):溴水,过滤 |
| C、乙酸乙酯(乙酸):氢氧化钠溶液,分液 |
| D、乙烷(乙烯):溴水,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的PH值增大;碳酸钠溶液的水解程度减小 |
| B、Na+和CO32-的浓度都减小 |
| C、阴极与阳极析出的气体物质的量之比为1:2 |
| D、溶液的浓度不变,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
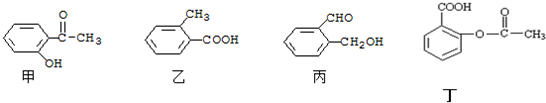
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
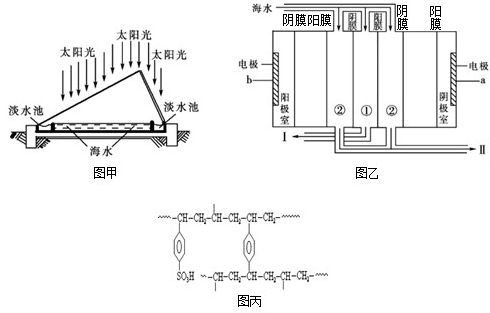
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡 常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
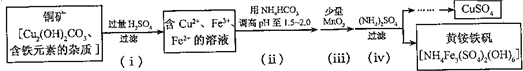
+ 4 |
2- 4 |
2- 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com