
| A、HgO→O2 |
| B、H2O2→O2 |
| C、CuO→H2O |
| D、H2O2→H2O |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、根据能量守定律可知,反应物的总能量等于生成物的总能量 |
| B、酸碱中和反应是放热的 |
| C、氢氧化钡晶体与氯化铵固体反应是吸热的 |
| D、化学能可以转化为热能、电能、光能等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能够使甲基橙呈现黄色 |
| B、溶液的pH>7 |
| C、溶液中:c(H+)<c(OH-) |
| D、溶液中:c(H+)>1×10-7mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L H2O含有的分子数等于0.1NA |
| B、常温下,100 mL 1mol/L Na2CO3溶液中钠离子总数为0.1NA |
| C、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、24g O2分子和24g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③④ |
| C、②③⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F |
 |
 |
 |
 |
 |
 |
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 |
2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体. |
| 褪色时间 | 31秒 | 4秒 |
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.8 | 1.0 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
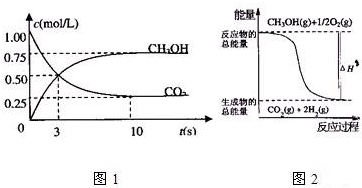
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
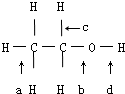 ,判断发生反应其所断裂的键.
,判断发生反应其所断裂的键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com