
【题目】按要求答题:
(1)海水是一个巨大的资源宝库,海水开发利用制取Cl2的离子方程式:____________。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:____________。
(3)除去Na2CO3粉末中混入的NaHCO3杂质最佳方法是_________,化学方程式为___________。
(4)除去CO2气体中混入的HCl气体杂质,需将气体通入_________中,其离子方程式为______。
(5)生活中通常用二氧化碳做灭火剂,但镁条着火不能用二氧化碳灭火,其相关原因的化学方程式是: ____________________________________。
【答案】2Cl-+ 2H2O ![]() Cl2 ↑+ H2↑+2OH- 2Na2O2+ 2CO2
Cl2 ↑+ H2↑+2OH- 2Na2O2+ 2CO2 ![]() O2 +2 Na2CO3 加热 2NaHCO3
O2 +2 Na2CO3 加热 2NaHCO3 ![]() CO2↑+ H2O+ Na2CO3 饱和NaHCO3溶液 H++ HCO3-
CO2↑+ H2O+ Na2CO3 饱和NaHCO3溶液 H++ HCO3-![]() CO2↑+H2O 2Mg+CO2
CO2↑+H2O 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
(1)海水开发利用电解饱和食盐水制取Cl2;
(2)过氧化钠与二氧化碳反应生成碳酸钠与氧气;
(3)NaHCO3受热易分解,碳酸钠较稳定;
(4)依据除杂原则,饱和NaHCO3溶液可除去CO2气体中混入的HCl气体杂质;
(5)镁可与二氧化碳反应生成C与氧化镁。
(1)海水开发利用制取Cl2的离子方程式为:2Cl-+ 2H2O ![]() Cl2 ↑+ H2↑+2OH-,
Cl2 ↑+ H2↑+2OH-,
故答案为:2Cl-+ 2H2O ![]() Cl2 ↑+ H2↑+2OH-;
Cl2 ↑+ H2↑+2OH-;
(2)过氧化钠与二氧化碳反应的化学方程式为2Na2O2+ 2CO2 ![]() O2 +2 Na2CO3,
O2 +2 Na2CO3,
故答案为:2Na2O2+ 2CO2 ![]() O2 +2 Na2CO3;
O2 +2 Na2CO3;
(3)因NaHCO3固体受热易分解,而Na2CO3粉末不会分解,所以除去Na2CO3粉末中混入的NaHCO3杂质最佳方法为加热,其相关的化学方程式为:2NaHCO3 ![]() CO2↑+ H2O+ Na2CO3,
CO2↑+ H2O+ Na2CO3,
故答案为:加热;2NaHCO3 ![]() CO2↑+ H2O+ Na2CO3;
CO2↑+ H2O+ Na2CO3;
(4)除去CO2气体中混入的HCl气体杂质,需将气体通入饱和NaHCO3溶液,因为饱和NaHCO3溶液既可以吸收氯化氢,又降低了CO2在水中的溶解度,达到除杂目的,其反应的离子方程式为:H++ HCO3-![]() CO2↑+H2O,
CO2↑+H2O,
故答案为:H++ HCO3-![]() CO2↑+H2O;
CO2↑+H2O;
(5)镁条与二氧化碳在点燃条件下会发生反应,所以镁条着火不能用二氧化碳灭火,其相关原因的化学方程式是:2Mg+CO2![]() 2MgO+C,
2MgO+C,
故答案为:2Mg+CO2![]() 2MgO+C。
2MgO+C。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确的是

A. 阿克拉酮的分子式为C22H22O8
B. 分子中含有3个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质最多可与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲苯为原料合成治疗粘膜溃疡、创面等的镇痛药物苯佐卡因及食用香料中间体E的路线如下:
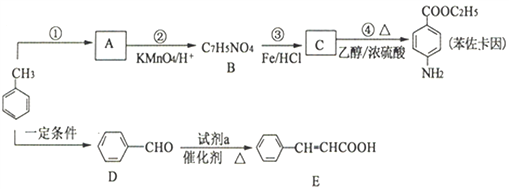
已知:
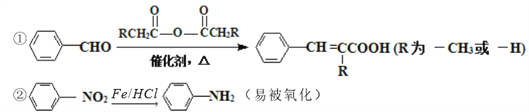
请回答下列问题:
(1)反应①所用试剂和条件是__________,B分子中含氧官能团的名称是__________。
(2)反应④的化学方程式为__________________________________________________。
(3)试剂a的结构简式为____________________________________________________。
(4)E有多种同分异构体,符合下列条件的有_________种。
①苯环上有三个取代基;②能发生银镜反应,且1mol该有机物生成4molAg
写出其中一种核磁共振氢谱有4个峰,且峰面积之比为1:2:2:3的有机物的结构简式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
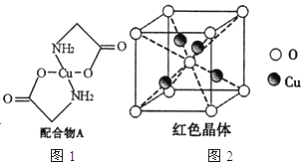
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到相应实验目的的是
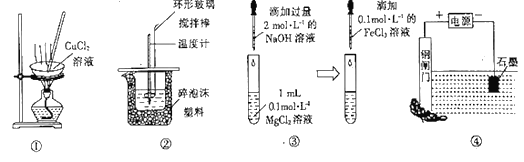
A. 操作①可从氯化铜溶液中直接蒸发结晶获得无水氯化铜
B. 装置②可用于测定中和热
C. 操作③可探究Mg(OH)2能否转化成Fe(OH)2
D. 装置④能保护钢闸门不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中只可能大量存在NH4+、Na+、Ag+、Ba2+、MnO4-、Fe3+、CO32-、SO42-、NO3-中的几种离子。从其中取两份各100mL,进行如下实验:
(1)不做任何实验就可以肯定原溶液中不存在的两种离子是_______、_______。
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体0.06mol。另取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀4.30 g,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33 g。综上所述说明原溶液中肯定存在的各离子浓度分别是(下面填写要求:例如c(Na+)=0.1 mol/L)
_____________、____________、____________、_____________(此空可以不填完)
(3)题干中的MnO4-是化学中的典型强氧化剂,另外生活中常用到的草酸(H2C2O4)是二元弱酸且具有还原性,二者在酸性条件下反应:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+ K2SO4+8H2O,该反应中氧化产物是___________(填名称),请写出该离子方程式并用双线桥标出电子转移的方向与数目:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题.
(1)含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是____。
A.铝合金 B.青铜 C.镁合金 D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为__________。
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 (填字母)
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)3晶体的方法如下:
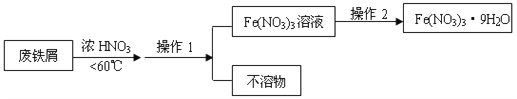
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为_______________。
②磁性氧化铁的化学式为______,试写出Fe2O3与硝酸反应的离子方程式_________________。
③操作1的名称为_____,操作2的步骤为:_____________,过滤,洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
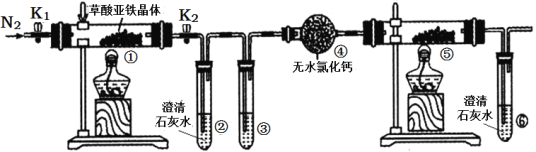
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com