
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管5~10min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
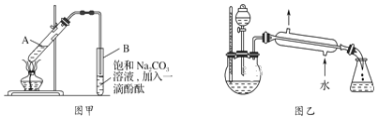
已知乙醇可以与氯化钙反应,生成微溶于水的CaCl26C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 |
乙醇 | ﹣117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | ﹣83.6 | 77.5 | 0.90 |
浓硫酸(98%) | 338.0 | 1.84 |
(1) 请用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O在反应前后位置变化的化学方程式:_______。
(2)上述实验中饱和Na2CO3溶液的作用是_____________。
(3)写出步骤③中观察到的实验现象______。
(4)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤,通过洗涤可除去的杂质是_____(填名称);干燥乙酸乙酯可选用的干燥剂为下列四个选项中的_____(填字母)。
a.P2O5 b.无水硫酸钠 c.碱石灰 d.NaOH固体
(5)某化学课外小组设计了图乙所示的装置制取乙酸乙酯(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有___(填字母)。
a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多,反应速率加快
(6)实验中加入乙酸的质量为2.1 g,最终制得1.848 g乙酸乙酯,则乙酸的转化率为_____
【答案】CH3CO18OH+C2H5OH![]() CH3COOC2H5+H218O 中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度有利于其分层析出; 试管B中的液体分为上下两层,上层为无色油状液体,可闻到水果香味,(振荡有气泡产生) 乙醇 b abc 60%
CH3COOC2H5+H218O 中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度有利于其分层析出; 试管B中的液体分为上下两层,上层为无色油状液体,可闻到水果香味,(振荡有气泡产生) 乙醇 b abc 60%
【解析】
(1)乙酸和乙醇在浓硫酸的催化作用下反应生成乙酸乙酯和水,脱水方式是酸脱羟基醇脱氢;
(2)乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,乙醇能够被溶液中的水吸收;
(3)乙酸乙酯是有香味的无色油状液体,不溶于饱和盐酸钠,密度小于水;
(4)根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析,干燥乙酸乙酯,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;
(5)从该装置与传统制备装置的使用的仪器的不同进行增加了温度计、增加反应物、增加了冷凝装置等;
(6)先计算出乙酸的物质的量,根据乙酸乙酯的质量计算反应的乙酸的物质的量,然后根据物质转化率计算公式得到乙酸的转化率。
(1)乙酸和乙醇在浓硫酸的催化作用下反应生成乙酸乙酯和水,反应时酸脱羟基醇脱氢,所以表示脱水方式的反应方程式为:CH3CO18OH+C2H5OH![]() CH3COOC2H5+H218O;
CH3COOC2H5+H218O;
(2)混合物加热时,乙醇和乙酸都挥发,随反应产生的乙酸乙酯进入到试管中,乙酸具有酸性,能和饱和碳酸钠溶液反应而把被吸收,乙醇能溶解在饱和碳酸钠溶液中,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,易于分离,所以饱和碳酸钠溶液的作用是中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度有利于其分层析出;
(3)乙酸乙酯是有香味的无色油状液体,不溶于饱和碳酸钠溶液,密度比水小,故③振荡后会观察到试管B中的液体分为上下两层,上层为无色油状液体,可闻到水果香味,下层无色;
(4)乙酸乙酯中混有碳酸钠和乙醇,用饱和食盐水萃取碳酸钠,用氯化钙除去其中的少量乙醇,反应产生CaCl26C2H5OH;用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;不能选择P2O5、碱石灰和NaOH等固体干燥剂,以防乙酸乙酯在酸性(P2O5遇水生成酸)或碱性条件下水解;
(5)a.从该装置与传统制备装置的使用的仪器的不同进行分析,增加了温度计,有利于控制发生装置中反应液的温度,a正确;
b.根据反应的可逆性特点,增加反应物有利于平衡向正方向移动,提高乙酸乙酯的产量,b正确;
c.增加了冷凝装置,有利于收集产物,c正确;
d.反应容器容积大,容纳反应物的量多,但物质的浓度不变,所以化学反应速率不变,d错误;
故合理选项是abc;
(6)乙酸的物质的量为n(乙酸)=![]() =0.035mol,反应产生的乙酸乙酯的物质的量为n(乙酸乙酯)=
=0.035mol,反应产生的乙酸乙酯的物质的量为n(乙酸乙酯)=![]() =0.021mol,根据反应方程式可知:每有1mol乙酸反应,会产生1mol乙酸乙酯,所以根据乙酸乙酯的物质的量可知反应消耗的乙酸的物质的量是0.021mol,则乙酸的转化率是
=0.021mol,根据反应方程式可知:每有1mol乙酸反应,会产生1mol乙酸乙酯,所以根据乙酸乙酯的物质的量可知反应消耗的乙酸的物质的量是0.021mol,则乙酸的转化率是![]() ×100%=60%。
×100%=60%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是 ( )
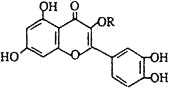
A. 可以使酸性KMnO4溶液褪色
B. 分子中有三个苯环
C. 1mol维生素P可以和4molNaOH反应
D. 维生素P与溴水反应时1mol维生素P可以消耗6molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )
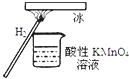
A. 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B. 水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下,一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③B.①③C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F都是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol·L-1D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法不正确的是

A. B晶体中阴、阳离子个数比为1:2
B. 等体积等浓度的F溶液与D溶液中,阴离子总的物质的量F>D
C. 0.1molB与足量A或C完全反应转移电子数均为0.1NA
D. Y、Z分别形成的简单氢化物的稳定性前者弱于后者,是因为后者分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法不正确的是( )
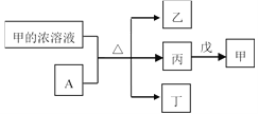
A.简单离子半径大小:X>Y
B.气态氢化物的还原性:X<Z
C.丁和戊中所含元素种类相同
D.W的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
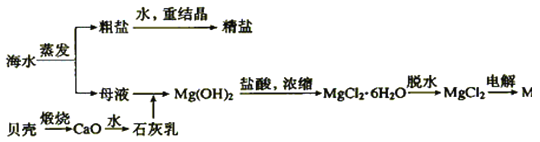
(1)写出下列反应的化学方程式。
①石灰乳与母液反应___;
②Mg(OH)2中加入盐酸的离子方程式:__;
③MgCl2![]() Mg:___。
Mg:___。
(2)在海水提取镁的过程中,没有涉及的化学反应类型__
A.分解反应 B.化合反应 C.复分解反应 D.置换反应 E.氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质.B与冷水缓慢反应,与沸水迅速反应,放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱.C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀.

请回答下列问题:
(1)组成B单质的元素在周期表第 周期第 族 .化合物C的电子式为 .
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式;
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有 个.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com