
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL某浓度的稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
(1)2~3min段的反应速率比1~2min段的反应速率__________(填“块”或“慢”),原因是______;
(2)求2~3min段以HCl的浓度变化来表示的平均反应速率(设溶液体积不变)____________;
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)____________。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
【答案】快 该反应为放热反应,释放的热量使温度升高,从而加快反应速率 0.1 mol·L-1·min-1 AB
【解析】
根据影响化学反应速率的因素有浓度、温度以及固体的表面积大小等因素,温度越高、浓度越大、固体表面积越大,反应的速率越大,从表中数据看出2min~3min收集的氢气比其他时间段多,原因是Zn置换H2的反应是放热反应,温度升高;4min~5min收集的氢气最少是因为随反应进行c(H+)下降;根据v=![]() 计算反应速率;根据根据影响化学反应速率的因素以及氢气的量取决于H+的物质的量。
计算反应速率;根据根据影响化学反应速率的因素以及氢气的量取决于H+的物质的量。
(1)从表中数据看出2 min~3 min收集的氢气比其他时间段多,虽然反应中c(H+)下降,但主要原因是Zn置换H2的反应是放热反应,温度升高,故2~3min段的反应速率比1~2min段的反应速率快;原因是:该反应为放热反应,释放的热量使温度升高,从而加快反应速率;
(2)在2~3min时间段内,n(H2)=![]() =0.005mol,由2HCl~H2得,消耗盐酸的物质的量为0.01mol,则υ(HCl)=
=0.005mol,由2HCl~H2得,消耗盐酸的物质的量为0.01mol,则υ(HCl)= =0.1 mol/(Lmin);
=0.1 mol/(Lmin);
④A、加入蒸馏水,溶液的浓度减小,反应速率减小,H+的物质的量不变,氢气的量也不变,选项A正确;
B、加入氯化钠溶液,减小盐酸的浓度,反应速率减小,H+的物质的量不变,氢气的量也不变,选项B正确;
C、加入Na2CO3溶液,Na2CO3能与盐酸反应,盐酸的浓度减小,反应速率减小,H+的物质的量减小,氢气的量也减小,选项C错误;
C、加入CuSO4溶液,锌能置换出铜,锌、铜、稀盐酸形成原电池,加快了化学反应速率,氢气的量不变,选项D错误;
答案选:AB。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】MOF衍生碳纳米棒封装的氧化铋催化剂对CO2电化学法制取HCOOH具有快速高效的选择性。其原理图如图,下列有关说法正确的是

A.该方法可有效消除CO2对大气造成的污染
B.该电极应与电源的正极相连
C.该电极反应式为:CO2-2e-+2H+=HCOOH
D.选择使用其他催化剂可能得到HCHO或CH3OH等产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
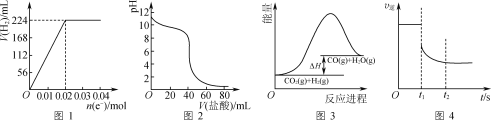
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 触摸试管情况 观察结果 反应完成所需的时间
粉末状 很烫 剧烈反应,带火星的木条复燃 3.5min
块状 微热 反应较慢,火星红亮但木条未复燃 30min
(1)写出上述实验中发生反应的化学方程式: .
(2)实验结果表明,催化剂的催化效果与 有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 .
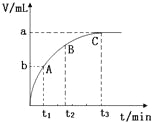
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是___。
[实验步骤]
(1)称取10.8g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0molL-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥___mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将___(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用如图1实验装置完成实验:
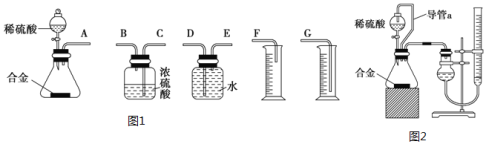
你认为最简易的装置其连接顺序是A接___接___接___(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图2所示的实验装置。
①装置中导管a的作用是___。
②实验前后碱式滴定管中液面读数分别为V1mL、V2mL,则产生氢气的体积为___mL。
③若需确定产生氢气的量,还需测定的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在0.1mol·L-1的Na2CO3溶液中,阴离子总数一定大于0.1NA
B.常温常压下,由32gO2与O3组成的混合气体中含有的分子总数小于NA
C.36.0gCaO2与足量水完全反应,转移的电子数为NA
D.1molCH4与1molCl2混合,充分反应后,生成气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com