
����Ŀ����þ�Ͻ��Ƿɻ����졢������������ҵ����Ҫ���ϣ��о���ѧϰС���ͬѧ��Ϊ�ⶨij��þ3%��5%����þ�Ͻ�(��������Ԫ��)��þ������������������������ֲ�ͬʵ�鷽������̽������д���пհף�
[����һ]
[ʵ�鷽��]����þ�Ͻ�������NaOH��Һ��Ӧ���ⶨʣ�����������
ʵ���з�����Ӧ�Ļ�ѧ����ʽ��___��
[ʵ�鲽��]
(1)��ȡ10.8g��þ�Ͻ��ĩ��Ʒ���������ΪV�����ʵ���Ũ��Ϊ4.0molL-1NaOH��Һ�У���ַ�Ӧ����NaOH��Һ�����V��___mL��
(2)���ˡ�ϴ�ӡ�����������塣�ò�������δϴ�ӹ��壬���þ������������___(����ƫ��������ƫ����������Ӱ����)��
[������]
[ʵ�鷽��]����þ�Ͻ�������ϡ������Һ��Ӧ���ⶨ��������������
[ʵ�鲽��]
(1)ͬѧ����ѡ����ͼ1ʵ��װ�����ʵ�飺
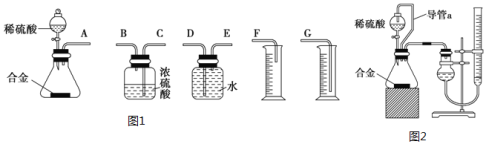
����Ϊ�����װ��������˳����A��___��___��___(��ӿ���ĸ���ɲ�����)��
(2)��ϸ����ʵ��װ�ú�ͬѧ�Ǿ�������Ϊ�������������ϴ���ϡ���������ƿ�У���ʹ������������Ҳ�Ὣƿ�ڿ����ų���ʹ�����������ƫ��ʵ�����ʱ�����ӹ��ƿ����Ͳ�ĵ�����������ˮ���ڣ�ʹ�����������ƫС�����������������ͼ2��ʾ��ʵ��װ�á�
��װ���е���a��������___��
��ʵ��ǰ���ʽ�ζ�����Һ������ֱ�ΪV1mL��V2mL����������������Ϊ___mL��
������ȷ��������������������ⶨ��������___��
���𰸡�2Al+2NaOH+2H2O=2NaAlO2+3H2�� 97 ƫ�� E D G ���ַ�Һ©��������ѹǿ����ƿ������ѹǿ��ȣ���Һ©������ʱϡ������˳�����£�������ƿ��ϡ����������ڽ����Һ©��������������Ӷ��������ڼ���ϡ������������������� V1-V2 ʵ��ʱ���¶Ⱥ�ѹǿ
��������
����һ��(1)þ������������Сʱ�������������������Ҫ������������Һ��࣬ʵ����Ҫ����������Һ�����Ӧ���ڻ�������ֵ���ݴ˼��㣻
��������(1)װ��A�кϽ���ϡ���ᷴӦ��������������������ˮ����������ˮ���ⶨ���������������ʢˮ���Լ�ƿ����һ��Ҫ�̽�����������ѹǿ��ˮ�ų���������Ͳ��ˮ������������������������Ϊ��ֹҺ��ɽ�����Ͳ�е�����Ҫ������Ͳ�ײ���
����һ����������������Һ��Ӧ����ƫ����������������Ӧ����ʽΪ2Al+2NaOH+2H2O=2NaAlO2+3H2����
(1)��þΪ3%ʱ���������ĺ�����ߣ���ʱ���ĵ�NaOH��Һ������10.8g�Ͻ�����������Ϊ��10.8g��(1-3%)=(10.8g��97%)g��NaOH��Һ��Ũ��Ϊ4.0mol/L������ݷ���ʽ��֪�����V= =0.097L=97mL����V(NaOH��Һ)��97mL��
=0.097L=97mL����V(NaOH��Һ)��97mL��
(2)���˵õ��Ĺ���Ϊþ��þ�ϻḽ��ƫ�����Ƶ����ʣ�δϴ�ӵ��²ⶨ��þ������ƫ��þ����������ƫ�ߣ�
��������(1)���ݷ�����֪�����װ������˳��Ϊ��(A)��(E)��(D)��(G)��
(2)��װ���е���a���Ա��ַ�Һ©��������ѹǿ����ƿ������ѹǿ��ȣ���Һ©������ʱϡ������˳�����£�������ƿ��ϡ����������ڽ����Һ©��������������Ӷ��������ڼ���ϡ������������������
�ڵζ��ܵ���̶����Ϸ������ε����֮��Ϊ�ⶨ��������������ռ�������ζ�����Һ�������С�����Բⶨ���������ΪV1-V2��
�������������¶Ⱥ�ѹǿ��Ӱ��ϴ���Ҫȷ����������ʵ���������֪��ʵ��ʱ���¶Ⱥ�ѹǿ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�����ӷ���ʽ��ȷ����
A. �ƺ���ˮ��Ӧ��Na+2H2O=Na++2OH��+H2��
B. ��С�մ�����θ����ࣺ![]() +H+=CO2��+H2O
+H+=CO2��+H2O
C. �Ȼ�����Һ�м��������ˮ��Al3++3OH��=Al��OH��3��
D. ���Ȼ�����Һ�м������ۣ�Fe3++Fe=2Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�еķ�Ӧ���»��ߴ���ʾȼ�������� ���� ����
A.NH3(g) +![]() O2(g) = NO(g) +
O2(g) = NO(g) +![]() H2O(g) ��H=-a kJ��mol-1
H2O(g) ��H=-a kJ��mol-1
B.C6H12O6(s) + 6O2(g) = 6CO2(g) + 6H2O(g) ��H=-b kJ��mol-1
C.CO(g) +![]() O2(g) = CO2(g)����H=-c kJ��mol-1
O2(g) = CO2(g)����H=-c kJ��mol-1
D.CH3CH2OH(l) +![]() O2(g) = CH3CHO(l) + H2O(l)����H=-d kJ��mol-1
O2(g) = CH3CHO(l) + H2O(l)����H=-d kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������100mLijŨ�ȵ�ϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ������ѻ���ɱ�״̬����
ʱ�䣨min�� | 0 | 1 | 2 | 3 | 4 | 5 |
���������mL�� | 0 | 50 | 120 | 232 | 290 | 310 |
(1)2~3min�εķ�Ӧ���ʱ�1~2min�εķ�Ӧ����__________(����������������)��ԭ����______��
(2)��2��3min����HCl��Ũ�ȱ仯����ʾ��ƽ����Ӧ���ʣ�����Һ������䣩____________��
(3)�����Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ������������������������зֱ����������������Һ������Ϊ���е��ǣ����ţ�____________��
A������ˮ B��NaCl��Һ C��Na2CO3��Һ D��CuSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ�����Ϊ5L�ĺ����ܱ������н��У� ��0-3�����ڸ����ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壬��A��������ɫ����
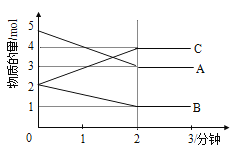
��1���÷�Ӧ�ĵĻ�ѧ����ʽΪ_____________________________��
��2����Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����Ϊ_________��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����___________��
a��v(A)= 2v(B) b�������ڸ����ʵ����ʵ������
c��v��(A)=v��(C) d���������������ɫ���ֲ���
��4����ͼ���ƽ��ʱA��ת����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�ֳ��õ�ҽҩ�м��壬��ṹ��ͼ��ʾ,�����й�˵����ȷ���ǣ� ��
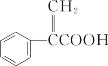
A.������ķ���ʽΪC9H6O2
B.���������������ԭ�ӿ��ܴ���ͬһƽ��
C.��һ�������£�1mol����������ܺ�5molH2������Ӧ
D.�������ܷ���ȡ�����ӳɡ�ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС������ͼ��ʾ��װ�ü�ҩƷ��������ǿ���Ƚϵ�ʵ�顣����˵����ȷ����

A.�ٺ͢��з����ķ�Ӧ��Ϊ�û���Ӧ
B.�����������䣬�����������ϡ����
C.һ��ʱ������н���״��������
D.��ʵ��֤�����ԣ�����>����>̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaS�ڻ����������Ʊ����·�����ϵȷ�����;�dz��㷺���ش��������⣺
(1)��ȡCaS�ķ�Ӧ���£�
��Ӧ(I)��CaSO4(s)��2C(s)![]() CaS(s)��2CO2(g) ��H1
CaS(s)��2CO2(g) ��H1
��Ӧ(II)��CaCO3(s)��H2S(g)![]() CaS(s)��H2O(g)��CO2(g) ��H2=��165kJ��mol-1
CaS(s)��H2O(g)��CO2(g) ��H2=��165kJ��mol-1
�����ں��º����ܱ�������ֻ������Ӧ(I)���ﵽƽ��ʱ��������ͨ������CO2����Ӧ�ٴδﵽƽ��ʱc(CO2)��___(��������������С������������)��
����֪�����Ȼ�ѧ����ʽ��.
i��S2(g)��CaSO4(s)![]() CaS(g)��2SO2(g) ��H=��240.4kJ��mol-1
CaS(g)��2SO2(g) ��H=��240.4kJ��mol-1
ii��2SO2(g)��4CO(g)=S2(g)��4CO2(g) ��H=��16.0kJ��mol-1
iii��C(s)��CO2(g)=2CO(g) ��H=��172.5kJ��mol-1
��Ӧ(I)����H1=___kJ��mol-1��
�۷�Ӧ(II)����S___(����>����<������=��)0������Ӧ(II)�ں��º����ܱ������н��У���˵���÷�Ӧ�Ѵﵽƽ��״̬����___(����ĸ)��
A.v(H2O)��=v(CO2)��
B.������������ѹǿ������ʱ��仯
C.������ͬʱ����H2S(g)��CO2(g)��H2O(g)
D.��λʱ���ڶ���H-S�������C=O����Ŀ���
(2)CaS�ܱ����������������йط�Ӧ��lgKp���¶ȹ�ϵ��ͼ(KpΪ�Է�ѹ��ʾ��ƽ�ⳣ������ѹ=��ѹ�����ʵ���������ͼ��������ѹǿ��λΪkPa�ó�)��
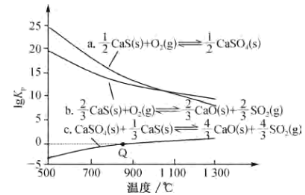
���������ȷ�Ӧ����___ (����a����b������c��)��
����ͬ�¶��£���Ӧa��b��c��lgKp(a)��lgKp(b)��lgKp(c)֮������Ĺ�ϵ��lgKp(c)=___��
�۷�Ӧc��Q��ʱ��p(SO2)=___kPa����Ũ�ȱ�ʾ��ƽ�ⳣ��Kc=___Kp[��R��T��ʾ����֪�����ѹǿ��������¶�����pV=nRT(nΪ��������ʵ�����RΪ����)]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaOH��Һ�ζ��ڱ���������أ��ڱ����������H2A��Ka1=1.1��103 ��Ka2=3.9��106����Һ�������Һ����Ե��������仯������ͼ��ʾ������b��Ϊ��Ӧ�յ㡣���������������

A. �����Һ�ĵ�������������Ũ�Ⱥ������й�
B. Na+��A2�ĵ�������֮�ʹ���HA��
C. b��Ļ����ҺpH=7
D. c��Ļ����Һ�У�c(Na+)>c(K+)>c(OH)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com