
【题目】下列热化学方程式中的反应热下划线处表示燃烧热的是 ( )
A.NH3(g) +![]() O2(g) = NO(g) +
O2(g) = NO(g) +![]() H2O(g) ΔH=-a kJ·mol-1
H2O(g) ΔH=-a kJ·mol-1
B.C6H12O6(s) + 6O2(g) = 6CO2(g) + 6H2O(g) ΔH=-b kJ·mol-1
C.CO(g) +![]() O2(g) = CO2(g) ΔH=-c kJ·mol-1
O2(g) = CO2(g) ΔH=-c kJ·mol-1
D.CH3CH2OH(l) +![]() O2(g) = CH3CHO(l) + H2O(l) ΔH=-d kJ·mol-1
O2(g) = CH3CHO(l) + H2O(l) ΔH=-d kJ·mol-1
科目:高中化学 来源: 题型:
【题目】高温下,Fe2O3和H2反应可转化为Fe3O4,方程式为3Fe2O3+H2![]() 2Fe3O4+H2O。下列说法正确的是( )
2Fe3O4+H2O。下列说法正确的是( )
A.Fe2O3俗名磁性氧化铁
B.该反应条件下H2的还原性强于Fe3O4的还原性
C.每消耗160 g Fe2O3,反应中转移2×6.02×1023个电子
D.Fe3O4可由Fe与H2O在常温下反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
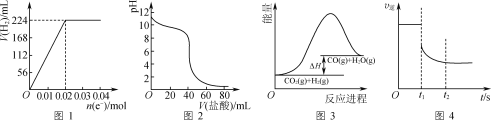
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金是飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是___。
[实验步骤]
(1)称取10.8g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0molL-1NaOH溶液中,充分反应。则NaOH溶液的体积V≥___mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将___(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用如图1实验装置完成实验:
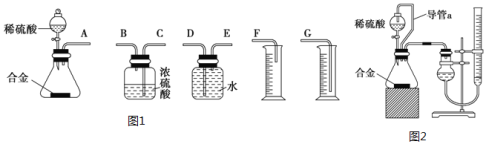
你认为最简易的装置其连接顺序是A接___接___接___(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图2所示的实验装置。
①装置中导管a的作用是___。
②实验前后碱式滴定管中液面读数分别为V1mL、V2mL,则产生氢气的体积为___mL。
③若需确定产生氢气的量,还需测定的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为同学们使用的一种碳素墨水笔,在组成这种墨水笔的各种材料中:
![]()
(1)属于有机高分子材料的是(选填一种即可)________。
(2)属于金属材料的是(填元素符号)________,______。
(3)目前世界上对废金属材料已得到回收利用,这样做的意义是______。
(4)碳素墨水是________(填“混合物”或“纯净物”)。
(5)写出其中的金属材料与硫酸铜溶液反应的一个化学方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com