
【题目】用可再生的物质制备乙酸乙酯的绿色合成路线之一如图所示:

⑴M的化学式为_______________________;
⑵反应③的反应类型为____________________;
⑶写出反应④的化学方程式: _____________________________;
⑷写出反应②的方程式: ______________________________。
【答案】C6H12O6 氧化反应 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O C6H12O6
CH3COOCH2CH3+H2O C6H12O6 ![]() 2 CH3CH2OH+2CO2↑
2 CH3CH2OH+2CO2↑
【解析】
淀粉或纤维素完全水解得到葡萄糖,葡萄糖经酒化酶的作用生成乙醇;乙醇可以被酸性高锰酸钾氧化生成乙酸,乙酸和乙醇发生酯化反应生成乙酸乙酯。
(1)M为葡萄糖,化学式为C6H12O6;
(2)乙醇到乙酸,增加了氧原子减少了氢原子,所以为氧化反应;
(3)该反应为乙酸和乙醇的酯化反应,方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)反应②为葡萄糖在酶的作用下生成乙醇和二氧化碳,方程式为C6H12O6 ![]() 2 CH3CH2OH+2CO2↑。
2 CH3CH2OH+2CO2↑。


科目:高中化学 来源: 题型:
【题目】
钒及其化合物在科学研究中和工业生产中具有许多用途。
(1)基态钒原子的核外价电子排布式为________。
(2)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______。
(3)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。例举与VO43-空间构型相同的一种阳离子__________(填化学式)。
(4)钒(Ⅱ)的配离子有[V(CN)6]4-、[V(H2O)6]2+等。
①CN-与N2互为等电子体,CN-中σ键和Π键数目比为________。
②对H2O与V2+形成[V(H2O)6]2+过程的描述不合理的是______________。
a.氧原子的杂化类型发生了变化
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角发生了改变。
d.H2O与V2+之间通过范德华力相结合。
③在[V(H2O)6]2+中存在的化学键有___________。
a.金属键 b.配位键 c. σ键 d.Π键 f. 氢键
(5)已知单质钒的晶胞如图,则V原子的配位数是_______,假设晶胞的边长为d nm,密度ρ g·cm-3,则钒的相对原子质量为_______________。(设阿伏伽德罗常数为NA)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应X(g)![]() 4Y(g)+Z(g),在200℃和T℃时,X 的物质的量浓度(单位:mol·L-1)随时间变 化的有关实验数据见下表:
4Y(g)+Z(g),在200℃和T℃时,X 的物质的量浓度(单位:mol·L-1)随时间变 化的有关实验数据见下表:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
200/℃ | 0.80 | 0.55 | 0.35 | 0.20 | 0.15 | 0.15 |
T/℃ | 1.00 | 0.65 | 0.35 | 0.18 | 0.18 | 0.18 |
下列有关该反应的描述正确的是
A. 在200℃时,4min内用Y表示的化学反应速率为0.1125mol·L-1·min-1
B. T℃下,6min时反应刚好达到平衡状态
C. 根据上表内 X 的浓度变化,可知浓度越大,反应速率越大
D. 从表中可以看出T <200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
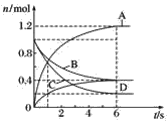
A.该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子![]() 分子或离子
分子或离子![]() 均含有18个电子:
均含有18个电子:
粒子 | A+ | B2- | C | D | E | F |
组成特点 | 单核离 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列说法错误的是
A.A的元素符号是K,B2-的离子结构示意图是![]()
B.C的浓溶液可用于实验室制Cl2
C.D的单质具有强氧化性,可将其同族元素的单质从盐溶液中置换出来
D.F中可能既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,可以由废旧锂钴电池正极材料(主要含Fe、Al、硅等杂质)回收钴,再用电化学法制得CoFe2O4。其流程如图所示(过程中所加试剂均足量)
Ⅰ.废旧电池中钴的回收

(1)含铝滤液中,铝元素的存在形式为________(写化学式);硅在过程_____(填序号)与钴分离。
(2)写出过程②中LiCoO2与H2O2发生反应的化学方程式____________________________。
(3)过程③Na2CO3的主要作用为________________________________________。
Ⅱ.电解法制得钴铁合金
(4)配制 0.050molL-1 FeSO4和0.025molL-1 CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为____________________________________。
Ⅲ.阳极氧化法制得钴铁氧体
(5)以1.500molL1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为_________________________。
(6)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为______________________________________________。
(7)由废旧锂钴电池制CoFe2O4的现实意义在于:______________________(写一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。无水乙醚微溶于水,熔点-116.3 ℃,沸点34.6 ℃,在空气中遇热易爆炸。实验室合成乙醚的原理如下:
主反应:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应:CH3CH2OH![]() H2C=CH2↑+H2O
H2C=CH2↑+H2O
(乙醚制备)装置设计如图所示(部分装置略):
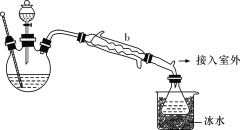
(1)仪器b应更换为下列中的________(填字母代号)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为________(填字母代号),取出乙醚立即密闭保存。
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物
c.检查装置气密性 d.熄灭酒精灯
e.通冷却水并加热烧瓶 f.拆除装置
g.控制滴加乙醇速率与馏出液速率相等
(3)反应温度不超过145 ℃,其目的是____________________。
(乙醚提纯)
![]()
(4)操作a的名称是__________;进行该操作时,必须用水浴加热代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com