
【题目】为防治含硫煤燃烧产生的大气污染,某工厂设计了新的治污方法,工艺流程如图所示。下列叙述错误的是( )
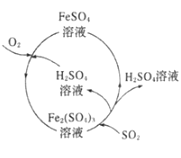
A.该流程可以除去煤燃烧时产生尾气中的SO2,变废为宝
B.该流程中H2SO4和Fe2(SO4)3溶液可以循环利用
C.流程中每吸收11.2LSO2(标准状况)同时产生1molFe2+
D.流程中涉及的Fe2+被氧化的反应的离子方程式为4Fe2++O2+2H2O═4Fe3++4OH-
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用如图装置进行SO2与FeCl3溶液反应的相关实验:
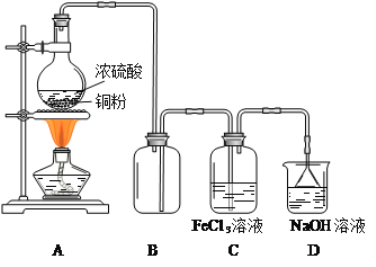
完成下列填空
(1)在配制FeCl3溶液时,需先把FeCl3晶体溶解在________中,再加水稀释,才能得到透明澄清溶液。
(2)B装置的作用是__________;D装置中吸收尾气的离子方程式是__________。
(3)A装置中制备SO2的化学方程式为:_______,在该反应中浓硫酸体现的性质是______。
(4)当温度较高的SO2气体(足量)通入FeCl3溶液中时,可以观察到溶液由黄色逐渐变为浅绿色。根据此现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
a.写出SO2与FeCl3溶液反应的离子方程式:___________。
b.请设计实验方案检验上述反应中FeCl3是否反应完全:_________________。
c.若向得到的浅绿色溶液中逐滴滴加NaOH溶液,可以观察到的现象是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A. 加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C. 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、钛、钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为__________,未成对电子数为________________。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①与BH4-互为等电子体的阳离子的化学式为_____。
②H、B、Ti原子的第一电离能由小到大的顺序为_____。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
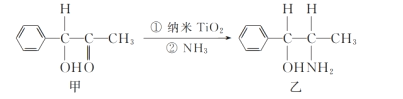
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是________________。
(5)铜与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为_____,HSCN结构有两种,已知硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S),其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2+(蓝色)+H2O+V3+(绿色) ![]() VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
A. 充电时,反应每生成2 mol H+时转移的电子的物质的量为1 mol
B. 充电时,阳极附近溶液由绿色逐渐变为紫色
C. 放电时,负极反应为V2+-e-===V3+
D. 放电过程中,正极附近溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是425℃时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。下列叙述错误的是
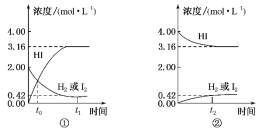
A.图①中t0时,三种物质的物质的量相同
B.图①中t0时,反应达到平衡状态
C.图②中的逆反应为H2(g)+I2(g) ![]() 2HI(g)
2HI(g)
D.图①②中当c(HI)=3.16 mol·L-1时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com