
ЁОЬтФПЁПФГбаОПадбЇЯАаЁзщгУШчЭМзАжУНјааSO2гыFeCl3ШмвКЗДгІЕФЯрЙиЪЕбщЃК
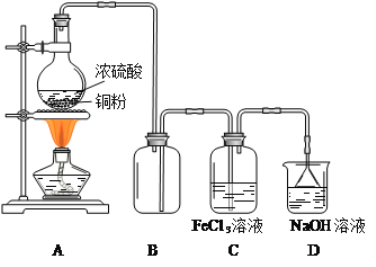
ЭъГЩЯТСаЬюПе
ЃЈ1ЃЉдкХфжЦFeCl3ШмвКЪБЃЌашЯШАбFeCl3ОЇЬхШмНтдк________жаЃЌдйМгЫЎЯЁЪЭЃЌВХФмЕУЕНЭИУїГЮЧхШмвКЁЃ
ЃЈ2ЃЉBзАжУЕФзїгУЪЧ__________ЃЛDзАжУжаЮќЪеЮВЦјЕФРызгЗНГЬЪНЪЧ__________ЁЃ
ЃЈ3ЃЉAзАжУжажЦБИSO2ЕФЛЏбЇЗНГЬЪНЮЊЃК_______ЃЌдкИУЗДгІжаХЈСђЫсЬхЯжЕФаджЪЪЧ______ЁЃ
ЃЈ4ЃЉЕБЮТЖШНЯИпЕФSO2ЦјЬхЃЈзуСПЃЉЭЈШыFeCl3ШмвКжаЪБЃЌПЩвдЙлВьЕНШмвКгЩЛЦЩЋж№НЅБфЮЊЧГТЬЩЋЁЃИљОнДЫЯжЯѓЃЌИУаЁзщЭЌбЇШЯЮЊSO2гыFeCl3ШмвКЗЂЩњСЫбѕЛЏЛЙдЗДгІЁЃ
a.аДГіSO2гыFeCl3ШмвКЗДгІЕФРызгЗНГЬЪНЃК___________ЁЃ
b.ЧыЩшМЦЪЕбщЗНАИМьбщЩЯЪіЗДгІжаFeCl3ЪЧЗёЗДгІЭъШЋЃК_________________ЁЃ
c.ШєЯђЕУЕНЕФЧГТЬЩЋШмвКжаж№ЕЮЕЮМгNaOHШмвКЃЌПЩвдЙлВьЕНЕФЯжЯѓЪЧЃК________ЁЃ
ЁОД№АИЁПХЈбЮЫс ЗРЕЙЮќ ![]()
![]() бѕЛЏадЁЂЫсад 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ ШЁЩйСПЗДгІКѓЕФШмвКгкЪдЙмжаЃЌЕЮМгЪЪСПKSCNШмвКЃЌШєШмвКБфКьЩЋдђFeCl3УЛгаЗДгІЭъШЋ ЩњГЩАзЩЋГСЕэЃЌбИЫйБфГЩЛвТЬЩЋЃЌзюжеБфГЩКьКжЩЋ
бѕЛЏадЁЂЫсад 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ ШЁЩйСПЗДгІКѓЕФШмвКгкЪдЙмжаЃЌЕЮМгЪЪСПKSCNШмвКЃЌШєШмвКБфКьЩЋдђFeCl3УЛгаЗДгІЭъШЋ ЩњГЩАзЩЋГСЕэЃЌбИЫйБфГЩЛвТЬЩЋЃЌзюжеБфГЩКьКжЩЋ
ЁОНтЮіЁП
ЃЈ1ЃЉХфжЦТШЛЏЬњШмвКЪБЃЌгІМгЯргІЕФЫсвжжЦЬњРызгЫЎНтЃЌдкЩеБжаЯЁЪЭХфжЦШмвКЃЛ
ЃЈ2ЃЉSO2ЛсШмгкFeCl3ШмвКЃЌашвЊЗРЕЙЮќзАжУЃЛЮВЦјжївЊЪЧЮДЗДгІЕФЖўбѕЛЏСђЃЛ
ЃЈ3ЃЉХЈСђЫсКЭЭЗлМгШШЬѕМўЯТЩњГЩЖўбѕЛЏСђЃЛ
ЃЈ4ЃЉaЃЎШ§МлЬњРызгПЩвдбѕЛЏЖўбѕЛЏСђЃЛ
bЃЎШ§МлЬњРызгПЩвдгыKSCNШмвКЗДгІЯдКьЩЋЃЛ
cЃЎЧтбѕЛЏбЧЬњШнвзБЛПеЦјбѕЛЏЁЃ
ЃЈ1ЃЉдкХфжЦТШЛЏЬњШмвКЪБЃЌашЯШАбТШЛЏЬњОЇЬхШмНтдкХЈбЮЫсжаЃЌдйМгЫЎЯЁЪЭЃЌетбљВйзїЕФФПЕФЪЧвжжЦЬњРызгЫЎНтЃЌЙЪД№АИЮЊЃКХЈбЮЫсЃЛ
ЃЈ2ЃЉSO2ЛсШмгкFeCl3ШмвКЃЌашвЊЗРЕЙЮќзАжУЃЛЖўбѕЛЏСђгыЧтбѕЛЏФЦРызгЗДгІЗНГЬЪНЮЊЃК![]() ЃЛЙЪД№АИЮЊЃКЗРЕЙЮќЃЛ
ЃЛЙЪД№АИЮЊЃКЗРЕЙЮќЃЛ![]() ЃЛ
ЃЛ
ЃЈ3ЃЉжЦБИSO2ЕФЛЏбЇЗНГЬЪНЮЊЃК![]() ЃЛИУЗДгІМШЬхЯжСЫХЈСђЫсЕФбѕЛЏадгжЬхЯжСЫЦфЫсадЃЌЙЪД№АИЮЊЃК
ЃЛИУЗДгІМШЬхЯжСЫХЈСђЫсЕФбѕЛЏадгжЬхЯжСЫЦфЫсадЃЌЙЪД№АИЮЊЃК![]() ЃЛбѕЛЏадЁЂЫсадЃЛ
ЃЛбѕЛЏадЁЂЫсадЃЛ
ЃЈ4ЃЉaЃЎШ§МлЬњРызгПЩвдбѕЛЏЖўбѕЛЏСђЃЌЙЪД№АИЮЊЃК2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ЃЛ
bЃЎЪЕбщЪвГЃгУKSCNМьбщШ§МлЬњРызгЃЌЙЪД№АИЮЊЃКШЁЩйСПЗДгІКѓЕФШмвКгкЪдЙмжаЃЌЕЮМгЪЪСПKSCNШмвКЃЌШєШмвКБфКьЩЋдђFeCl3УЛгаЗДгІЭъШЋЃЛ
cЃЎШєЯђЕУЕНЕФЧГТЬЩЋШмвКжаж№ЕЮЕЮМгNaOHШмвКЃЌЩњГЩЧтбѕЛЏбЧЬњГСЕэЃЌШнвзБЛбѕЦјбѕЛЏЃЌЙЪД№АИЮЊЃКЩњГЩАзЩЋГСЕэЃЌбИЫйБфГЩЛвТЬЩЋЃЌзюжеБфГЩКьКжЩЋЃЛ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЯђвЛЖЈХЈЖШЕФNa2XШмвКжаЕЮШыбЮЫсЃЌШмвКЕФpHгыРызгХЈЖШБфЛЏЙиЯЕШчЭМЫљЪОЁЃ

вбжЊЃКH2XЪЧЖўдЊШѕЫсЃЌYБэЪО![]() Лђ
Лђ![]() ЃЌpYЃНЉlgYЃЎЯТСаа№ЪіВЛе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
ЃЌpYЃНЉlgYЃЎЯТСаа№ЪіВЛе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A. ЧњЯпnБэЪОpHгыp![]() ЕФБфЛЏЙиЯЕ
ЕФБфЛЏЙиЯЕ
B. Ka2ЃЈH2XЃЉЃН1.0ЁС10Љ10.3
C. NaHXШмвКжаcЃЈH+ЃЉЃОcЃЈOHЉЃЉ
D. ЕБШмвКГЪжаадЪБЃЌcЃЈNa+ЃЉЃНcЃЈHXЉЃЉ+2cЃЈX2ЉЃЉ+cЃЈClЉЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКAЁЂBЁЂFЪЧМвЭЅжаГЃМћЕФгаЛњЮяЃЌFГЃгУгкЪГЦЗАќзАЃЌEЪЧЪЏгЭЛЏЙЄЗЂеЙЫЎЦНЕФБъжОЁЃИљОнЯТУцзЊЛЏЙиЯЕЛиД№ЮЪЬтЁЃ

ЃЈ1ЃЉЗжБ№аДГіAКЭEжаЙйФмЭХЕФУћГЦЃКAжа_________ЃЛEжа_________ЃЛ
ЃЈ2ЃЉВйзїЂоЕФУћГЦЮЊ________________ЁЃ
ЃЈ3ЃЉаДГіЗДгІРраЭЃКЂм_________ЃЛ
ЃЈ4ЃЉЧыаДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪНЃК
ЂйаДГіAКЭBдкХЈСђЫсжаМгШШЗДгІЕФЗНГЬЪН_________________ЃЛ
ЂкBдкН№ЪєЭДцдкЯТдкПеЦјжаМгШШЗДгІ________________ЃЛ
ЃЈ5ЃЉFЪЧвЛжжГЃМћЕФИпЗжзгВФСЯЃЌЫќИјЮвУЧДјРДСЫОоДѓЕФЗНБуЁЃШЛЖјЃЌетжжВФСЯдьГЩЕФЕБНёЕФФГвЛЛЗОГЮЪЬтЪЧ__________________.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛюадЬПЛЙдЗЈвВПЩвдДІРэЕЊбѕЛЏЮяЁЃЯђФГУмБеШнЦїжаМгШызуСПЕФЛюадЬПКЭвЛЖЈСПNOЃЌЗЂЩњЗДгІC(s) + 2NO(g)![]() N2(g) + CO2(g) + QЃЈQЃО0ЃЉЁЃдкT1ЁцЪБЃЌЗДгІНјааЕНВЛЭЌЪБМфЃЌВтЕУШнЦїФкИїЮяжЪЕФЮяжЪЕФСПХЈЖШШчЯТЃК
N2(g) + CO2(g) + QЃЈQЃО0ЃЉЁЃдкT1ЁцЪБЃЌЗДгІНјааЕНВЛЭЌЪБМфЃЌВтЕУШнЦїФкИїЮяжЪЕФЮяжЪЕФСПХЈЖШШчЯТЃК
ЪБМф /min | 0 | 10 | 20 | 30 | 40 | 50 | |
ХЈЖШ /molЁЄL-1 | NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 | |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 | |
ЂйИУЗДгІЕФЦНКтГЃЪ§БэДяЪНЮЊ________ЁЃ0-10 minФкNOЕФЦНОљЗДгІЫйТЪЮЊ____________ЁЃ
Ђк30 minКѓжЛИФБфФГвЛЬѕМўЃЌИљОнБэжаЪ§ОнХаЖЯИФБфЕФЬѕМўПЩФмЪЧ__________ЁЃЯргІЕиЃЌЦНКт__ЃЈбЁЬюБрКХЃЉЁЃ
aЃЎЯђе§ЗДгІЗНЯђвЦЖЏ bЃЎЯђФцЗДгІЗНЯђвЦЖЏ cЃЎВЛЗЂЩњвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнЯТСаЪЕбщзАжУЭМЛиД№ЃЈзАжУгУДњКХБэЪОЃЉ

ЂйЪЕбщЪвжЦгУИпУЬЫсМижЦбѕЦјЪБЃЌгІбЁгУЕФЗЂЩњзАжУЪЧ_____ЃЛжЦЧтЦјЪБгІбЁгУЕФЗЂЩњзАжУЪЧ_____ЃЌжЦЖўбѕЛЏЬМЪБгІбЁгУЕФЗЂЩњзАжУЪЧ_____ЃЌМьбщЖўбѕЛЏЬМЦјЬхПЩбЁгУDзАжУЃЌЦфзАжУжаЪЂЗХЕФЪдМСвЛАуЪЧ_______ЁЃ
ЂкгУаПСЃКЭХЈбЮЫсЗДгІжЦЧтЦјЃЌНЋжЦГЩЕФЦјЬхЭЈШыЯѕЫсвјЃЌгаАзЩЋГСЕэЃЌЫЕУїЧтЦјжаКЌгаЃЈаДЛЏбЇЪНЃЉ_____ЃЌЗДгІЗНГЬЪНЮЊ______ЃЌШєвЊжЦГіДПОЛЕФЧтЦјЃЌГ§ЗЂЩњзАжУЭтЛЙгІбЁгУЕФвЛжжзАжУЪЧ_____ЃЛИУзАжУжавЉЦЗЕФзїгУЪЧ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕЊЁЂСзЁЂСђЁЂТШдЊЫидкПЦбагыЩњВњжавВгааэЖрживЊЕФгУЭОЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉСздзгдкГЩМќЪБЃЌФмНЋвЛИі3sЕчзгМЄЗЂНјШы3dФмМЖЖјВЮМгГЩМќЃЌаДГіИУМЄЗЂЬЌдзгЕФКЫЭтЕчзгХХВМЪН________ ЁЃ
ЃЈ2ЃЉNКЭPЖМга+5МлЃЌPCl5ФмаЮГЩРызгаЭОЇЬхЃЌОЇИёжаКЌга[PCl4]+КЭ[PCl6]ЃЃЌдђ[PCl4]+ПеМфЙЙаЭЮЊ___________ЁЃЕЋNCl5ВЛДцдкЃЌЦфдвђЪЧ___________________ЁЃ
ЃЈ3ЃЉNЁЂPСНжждЊЫиЖМФмаЮГЩЖржжЦјЬЌЧтЛЏЮяЁЃСЊАБЃЈN2H4)ЮЊЖўдЊШѕМюЃЌдкЫЎжаЕФЕчРыгыАБЯрЫЦЃЌаДГіСЊАБдкЫЎжаЕквЛВНЕчРыЗНГЬЪН_______________________ЁЃ
ЃЈ4ЃЉЂйЧыЭЦВтЂйHC1O4ЁЂЂкH5IO6[ПЩаДГЩ(HO)5IO]ЁЂЂлHIO4Ш§жжЮяжЪЕФЫсадгЩЧПЕНШѕЕФЫГађЮЊ_________(ЬюађКХ)ЁЃ
ЂквбжЊвЛЖЈЬѕМўЯТЗЂЩњЗДгІЃКNa2O+NaCl=Na3OClЃЌИУЗДгІЙ§ГЬжаЦЦЛЕКЭаЮГЩЕФЛЏбЇМќга_________ЁЃ
ЃЈ5ЃЉИДдгСзЫсбЮгажБСДЖрСзЫсбЮЃЈШчЭМbЃЉКЭЛЗзДЦЋСзЫсбЮЃЈШчЭМcЃЉЁЃЦфЫсИљвѕРызгЖМЪЧгЩСзбѕЫФУцЬхЃЈЭМaЃЉЭЈЙ§ЙВгУбѕдзгСЌНгЖјГЩЁЃжБСДЖрСзЫсбЮЕФЫсИљРызгЃЈЭМbЃЉжаЃЌСздзгКЭбѕдзгЕФдзгИіЪ§БШЮЊnЃК____ЃЛКЌ3ИіСздзгЕФЛЗзДЦЋСзЫсбЮЕФЫсИљРызгЃЈЭМcЃЉЕФЛЏбЇЪНЮЊ_____ЁЃ

ЃЈ6ЃЉЖрдзгЗжзгжаИїдзгШєдкЭЌвЛЦНУцЃЌЧвгаЛЅЯрЦНааЕФpЙьЕРЃЌдђpЕчзгПЩдкЖрИідзгМфдЫЖЏЃЌаЮГЩРыгђІаМќЁЃЗжзгжаЕФІаМќПЩгУЗћКХІА![]() БэЪОЃЌЦфжаmДњБэВЮгыаЮГЩДѓІаМќЕФдзгЪ§ЃЌnДњБэВЮгыаЮГЩДѓІаМќЕФЕчзгЪ§ЃЌШчБНЗжзгжаЕФДѓІаМќПЩБэЪОЮЊІАЃЌдђSO2жаЕФДѓІаМќгІБэЪОЮЊ___________ЁЃ
БэЪОЃЌЦфжаmДњБэВЮгыаЮГЩДѓІаМќЕФдзгЪ§ЃЌnДњБэВЮгыаЮГЩДѓІаМќЕФЕчзгЪ§ЃЌШчБНЗжзгжаЕФДѓІаМќПЩБэЪОЮЊІАЃЌдђSO2жаЕФДѓІаМќгІБэЪОЮЊ___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
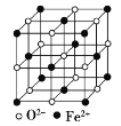
ЁОЬтФПЁПТСЁЂЬњдкЩњЛюЁЂЩњВњжагазХЙуЗКЕФгУЭОЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
(1) Fe2+ЕФзюЭтВуЕчзгХХВМЪН____________ЁЃдЊЫиFeгыMnЕФЕкШ§ЕчРыФмЗжБ№ЮЊI3(Fe)ЁЂI3(Mn)ЃЌдђI3(Fe)______I3(Mn)(ЬюЁА>ЁБЁЂЁА<")ЁЃ
(2)ЦјЬЌТШЛЏТСЕФЗжзгзщГЩЮЊ(AlCl3)2ЃЌЦфжаAlЁЂClОљДя8e-ЮШЖЈНсЙЙЃЌAlдзгЕФдгЛЏЗНЪНЮЊ__________ЁЃИљОнЕШЕчзгдРэЃЌAlO2-ЕФПеМфЙЙаЭЮЊ_____ЁЃ
(3) Fe(CO)5ЕФШлЕуЮЊ-20 ЁцЃЌЗаЕуЮЊ103 ЁцЃЌвзШмгкввУбЃЌЦфОЇЬхРраЭЮЊ______ЃЌ
(4) ПЦбЇМвУЧЗЂЯжФГаЉКЌЬњЕФЮяжЪПЩДпЛЏФђЫиКЯГЩыТ(N2H4)ЃЌЗаЕуЃКN2H4>C2H6ЕФжївЊдвђЮЊ______________________ЁЃ
(5) FeOОЇЬхЕФОЇАћШчЭМЫљЪОЃЌМКжЊЃКFeOОЇЬхЕФУмЖШЮЊІб g/cm3ЃЌNAДњБэАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃдкИУОЇАћжаЃЌгыFe2+НєСкЧвЕШОрРыЕФFe2+Ъ§ФПЮЊ_____ЃЛFe2+гыO2-зюЖЬКЫМфОрЮЊ______pm(гУІбКЭNAБэЪО)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщЮЊЬНОПSO2ЕФаджЪЃЌАДЯТЭМЫљЪОзАжУНјааЪЕбщЁЃ
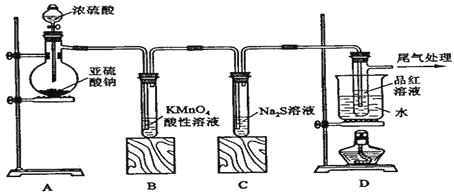
ЧыЕНД№FСаЮЪЬтЃК
ЃЈ1ЃЉзАжУAжаЪЂЗХбЧСђЫсФЦЕФвЧЦїУћГЦЪЧ ЃЌЦфжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЃЛ
ЃЈ2ЃЉЪЕбщЙ§ГЬжаЃЌзАжУBЁЂCжаЗЂЩњЕФЯжЯѓЗжБ№ЪЧ ЁЂ ЃЌетаЉЯжЯѓЗжБ№ЫЕУїSO2ОпгаЕФаджЪЪЧ КЭ ЃЛзАжУBжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ ЃЛ
ЃЈ3ЃЉзАжУDЕФФПЕФЪЧЬНОПSO2гыЦЗКьзїгУЕФПЩФцадЃЌЧыаДГіЪЕбщВйзїМАЯжЯѓ ЃЛ
ЃЈ4ЃЉЮВЦјПЩВЩгУ ШмвКЮќЪеЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊЗРжЮКЌСђУКШМЩеВњЩњЕФДѓЦјЮлШОЃЌФГЙЄГЇЩшМЦСЫаТЕФжЮЮлЗНЗЈЃЌЙЄвеСїГЬШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧЃЈ ЃЉ
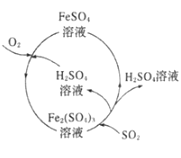
A.ИУСїГЬПЩвдГ§ШЅУКШМЩеЪБВњЩњЮВЦјжаЕФSO2ЃЌБфЗЯЮЊБІ
B.ИУСїГЬжаH2SO4КЭFe2ЃЈSO4ЃЉ3ШмвКПЩвдбЛЗРћгУ
C.СїГЬжаУПЮќЪе11.2LSO2ЃЈБъзМзДПіЃЉЭЌЪБВњЩњ1molFe2+
D.СїГЬжаЩцМАЕФFe2+БЛбѕЛЏЕФЗДгІЕФРызгЗНГЬЪНЮЊ4Fe2++O2+2H2OЈT4Fe3++4OH-
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com