
(11) 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)
(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式: 、 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3  2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是 ,并说明理由: 。
请你设计一个简单的实验证明你的结论是正确的: 。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律: 。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
(1)Ca(NO3)2受热分解的产物:Ca(NO2)2、O2
(2)Cu(NO3)2受热分解的化学方程式: 2Cu(NO3)2△2CuO+4NO2↑+O2↑
(3) Ⅱ正确;气泡仅部分消失,且剩余氧气等;取少量分解后固体,加入硝酸或氨水;
(4)硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关。 (5)85b/28a%
解析试题分析:(1)根据题意可得Ca(NO3)2分解的化学方程式:Ca(NO3)2△ Ca(NO3)2+O2 ↑,所以分解产物是Ca(NO3)2和O2;(2)根据题意可得Cu(NO3)2分解的化学方程式:2Cu(NO3)2△2CuO+4NO2↑+O2↑;(3)若是发生Ⅰ反应,由于4NO2+O2+2H2O=4HNO3,液体不会被压至装置③中。若是发生Ⅱ反应,由于产生的NO2和O2的体积比为2:1,所以氧气过量,因此还有不能转换的气体剩余,装置②中气泡部分消失,剩余的气体也能使带火星的木条复燃。溶液也变为红色,现象吻合。因此Ⅱ正确。证明结论的实验是取少量分解后固体,加入硝酸或氨水;观察现象进行分析得到结论。(4)硝酸盐受热分解的规律:硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关。特别活泼的金属的硝酸盐负极得到亚硝酸盐和氧气;比较活泼的金属的硝酸盐分解得到金属氧化物、二氧化氮和氧气,比活泼的金属的硝酸盐分解得到金属单质、二氧化氮和氧气。(5)2AgNO3 △2Ag+2NO2↑+O2↑,2NO2+1/2O2+H2O=2HNO3,反应中的物质的量的关系是2AgNO3~2NO2~1/2O2。若分解2×170g AgNO3,会有1/2×11200ml的水进入量筒,现在有bml的水,所以分解的AgNO3质量是m=2×170b÷11200g.而加入的AgNO3质量是ag,所以硝酸银的分解率是(m÷a)×100%=(2×170b÷11200g)÷a×100%=85b/28a%
考点:考查硝酸盐的受热分解规律、化学方程式的书写、化学实验现象的原因及分解率的计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿。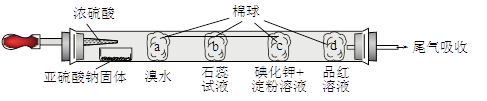
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
| 选项 | 现象 | 解释或结论 |
| A | a处黄色褪去 | 非金属性:Br>S |
| B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
| C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
| D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在KBr和KI的混合液中通入过量的Cl2,除了水分子外,溶液中主要有 ______分子,若把溶液蒸干得到固体灼烧后还剩下 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NH3经一系列反应可以得到HNO3,如下图所示。
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是_____________________。
(2)II中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
(3)III中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)△H1
N2O4(g)△H1
2NO2(g) N2O4(l)△H2
N2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)_______________。
②N2O4与O2、H2O化合的化学方程式是_________________。
(4)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
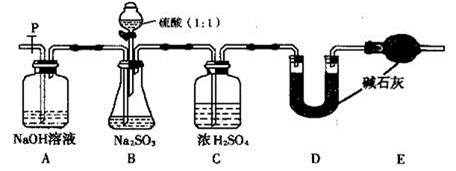
(17分)Na2SO3固体在空气中久置容易变质 。
(I)Na2SO3固体在空气中变质的主要原因,用化学方程式表示为 。
(II)为探究Na2SO3样品的变质情况,现提出以下假设:
假设1:Na2SO3样品完全变质; 假设2:Na2SO3样品完全没有变质;假设3: 。
补充完成以下实验过程及现象和结论,完成探究。
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 离子,假设1不成立。 ②褪色的离子方程式为: 。 |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 ; 结论:假设2成立。 |
| …… | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强。常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为 ,气体单质D对应元素在周期表中的位置为 。
(2)用化学方程式表示B溶液酸性增强的原因 。
(3)气体A与NH3反应的化学方程式为 ,该反应体现气体A具有 性。
(4)试写出制取气体A的化学方程式为 。
(5)设计实验探究离子晶体C的成分为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)【化学—化学与技术】
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为 ,该反应在 中进行(填设备名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的 (填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有 ;SO3进入 (填设备名称)用____ 吸收,得到浓硫酸或发烟硫酸。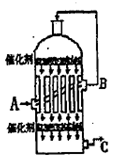
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 。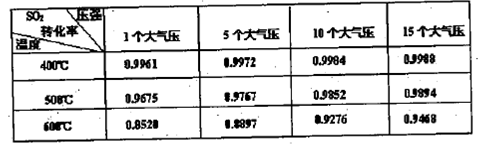
(4)吸收塔排出的尾气中SO2的含量如果超过500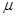 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
实验操作及现象:
| 实验操作 | 现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
| Ⅳ.用F装置向E装置中鼓入空气 | E装置内气体颜色逐渐加深 |
| Ⅴ.一段时间后 | C装置中白色沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是 。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]= 。
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。
①下列操作步骤的正确排序为 (填字母)。
| A.体系冷却后,停止通入Cl2 |
| B.通入干燥的Cl2赶尽装置中的空气 |
| C.在铁屑下方加热至反应完成 |
| D.用干燥的H2赶尽Cl2 |
 NaClO3+3H2
NaClO3+3H2 ,
, +Cl2
+Cl2 +2NaCl+2H2O。
+2NaCl+2H2O。| 物质 | 熔点/℃ | 沸点/℃ |
| C1O2 | -59 | 11 |
| Cl2 | -107 | -34.6 |
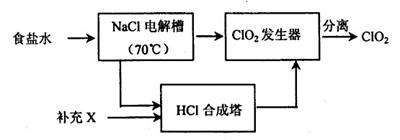
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com