
| A、最终得到7.8g的沉淀 |
| B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C、反应过程中得到6.72L的气体(标准状况下) |
| D、最终得到的溶液中c(NaCl)=2mol/L |
| 15.6g |
| 78g/mol |
| 5.4g |
| 27g/mol |
| 6.72L |
| 22.4L/mol |
| n |
| V |
| 15.6g |
| 78g/mol |
| 5.4g |
| 27g/mol |
| 6.72L |
| 22.4L/mol |
| 1 |
| 2 |
| 3 |
| 2 |
| 0.3mol |
| 0.2l |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 组号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O 体积(mL) | ||||
| 体积(mL) | 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | |||
| A | 0 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.1 | 5 | 0.2 | 10 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①②④ |
| C、①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得溶液的物质的量浓度:c=1mol/L | ||
B、所得溶液中Cl-的浓度为
| ||
| C、36.5g HCl气体的体积为22.4L | ||
| D、溶液的质量分数3.65% |
查看答案和解析>>
科目:高中化学 来源: 题型:
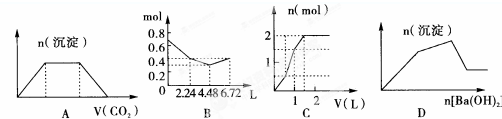
| A、将足量CO2通入含KOH和Ca(OH)2的混合液中,生成沉淀的物质的量(n)与通入CO2体积(y)的关系图A |
| B、往含0.2 molNaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通人CO2气体,当气体为6.72 L(标态)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系图B |
| C、向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol?L-1Ba(OH)2溶液,产生沉淀的物质的量(n)与加入B(OH)2溶液积(V)间的关系图C |
| D、KAl(SO4)2液中逐滴加入Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂是硫酸,还原剂是H2S |
| B、氧化产物是SO2,还原产物是S 和H2O |
| C、反应中的电子转移数是4 |
| D、H2S只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应中,发生物质变化的同时不一定发生能量变化 |
| B、反应:MgCO3(s)═MgO(s)+CO2(g),在高温下不能自发进行 |
| C、HR溶液导电性较弱,则HR属于弱电解质 |
| D、反应产物的总焓大于反应物的总焓时,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N3+离子中含有36个电子 |
| B、O2与O4属于同位素 |
| C、C50是原子晶体 |
| D、H2与H3互称为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com