
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,下列有关说法错误的是( )
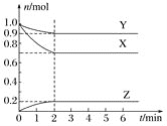
A.该反应的化学方程式为X+3Y2Z
B.2 min时,反应达最大限度,但化学反应仍在进行
C.反应开始至2min,Z的反应速率为0.05 mol·L-1·min-1
D.反应达到平衡时,压强是开始时的0.9倍
【答案】A
【解析】
由图可知,随反应进行X、Y的物质的量变小,为反应物,Z的物质的量变大,为生成物;在相等的时间内X、Y、Z的物质的量变化比值为3∶1∶2。
A.2min后各物质的量不再变化,说明为可逆反应,综合得化学方程式为3X+Y2Z,A错误,符合题意;
B.2min时可逆反应达到反应限度,但正、逆反应还在进行,B正确,与题意不符;
C. υ(Z)=![]() =0.05mol·L-1·min-1,C正确,与题意不符;
=0.05mol·L-1·min-1,C正确,与题意不符;
D.开始n(气体)=2 mol,平衡时n(气体)=(0.9+0.7+0.2)mol=1.8mol,压强之比等于物质的量之比,平衡时体系的压强是开始的0.9倍,D正确,与题意不符;
答案为A。


科目:高中化学 来源: 题型:
【题目】已知1mol下列物质完全燃烧生成稳定的产物时放出的热量如下:

则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2kJ·mol-1B.44.2kJ·mol-1
C.-330kJ·mol-1D.330kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。

(1)上表中,反应速率最快的是_______;
(2)实验3、4预期可得出的结论是_______;
(3)设计实验2、3的目的是_________;
(4)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族,A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称:A_______B________C________D_______E______
(2)用电子式表示离子化合物A2B的形成过程:_____________________
(3)写出下列物质的化学式、电子式或结构式:
①D元素形成的单质的结构式___________
②E和B形成化合物的电子式___________、___________
③A、B、E形成的化合物的化学式为________
④D、E形成的化合物空间结构型为________形_________性分子
⑤D、C、E形成的化合物的化学式为____________
⑥D、E形成的化合物为______化合物,(填“离子”或“共价”)包含的化学键为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯的主链含有-NHCOO-重复单元的一类新型高分子化合物,其单体是氰酸酯(如O=C=N-R-N=C=O)和多元醇(如HO-R’-OH)。其高聚物结构式如图所示:
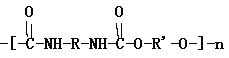
(1)由上述异氰酸酯和多元醇合成高聚物的反应属于___反应(填“加聚”,“缩聚”)。
(2)写出由2,6-甲基苯二异氰酸酯(如图所示) 和1,3-丙二醇为单体生成高聚物的化学方程式:___。
和1,3-丙二醇为单体生成高聚物的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下将Cl2缓慢通入水中。当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a。已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
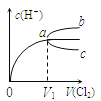
A.将饱和氯水加水稀释,溶液中c(H+)变化如曲线b
B.将饱和氯水降低温度,溶液中c(H+)变化如曲线c
C.在饱和氯水中加入NaOH使pH>7,所得溶液中存在下列关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(ClO-)
D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如图:

请回答下列问题:
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为__。
(2)溶液A中溶质除NaOH外,还有__。
(3)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有__(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是__。
③“钴渣”中LiCoO2溶解时的离子方程式为__。
(4)在“滤液1”中加入20﹪Na2CO3溶液,目的是__;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是__。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热。使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com