
【题目】工业合成氨的原理为N2(g)+3H2(g)![]() 2NH3(g),请回答下列问题:
2NH3(g),请回答下列问题:
(1)已知拆开1mol H﹣H键、1mol N≡N、1mol N﹣H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1mol NH3需要放出_________的热量。
(2)若N2、H2、NH3的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),则各物质的浓度有可能的是___________。
A.c=0.5mol/L B.b=0.5mol/L
C.c=0.4mol/L D.a=0.3mol/L
(3)若在2L密闭容器中,充入1 mol N2和3mol H2,2min时达到平衡。测得平衡时N2的浓度为0.3 mol/L。
①2min内v(NH3)=___________。
②平衡时容器的压强与起始时压强之比___________。
【答案】 46kJ B 0.2mol/(L·min) 4:5
【解析】分析:(1)根据ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量解答;
(2)根据合成氨是可逆反应,反应物不能完全转化为生成物判断;
(3)根据三段式计算。
详解:(1)已知拆开1mol H﹣H键、1mol N≡N、1mol N﹣H键分别需要吸收的能量为436kJ、946kJ、391kJ,则反应N2(g)+3H2(g)![]() 2NH3(g)的ΔH=(946+3×436-2×3×391)kJ/mol=-92kJ/mol,所以由N2和H2反应生成1molNH3需要放出92kJ/mol×1/2×1mol=46kJ的热量。
2NH3(g)的ΔH=(946+3×436-2×3×391)kJ/mol=-92kJ/mol,所以由N2和H2反应生成1molNH3需要放出92kJ/mol×1/2×1mol=46kJ的热量。
(2)若N2、H2、NH3的起始浓度依次为0.2mol/L、0.3mol/L、0.2mol/L,当反应达平衡时,浓度分别是a、b、c(mol/L),如果反应向正反应方向进行,假设反应物能完全转化,则
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L) 0.2 0.3 0.2
转化浓度(mol/L) 0.1 0.3 0.2
平衡浓度(mol/L) 0.1 0 0.4
如果反应向逆反应方向进行,假设反应物能完全转化,则
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L) 0.2 0.3 0.2
转化浓度(mol/L) 0.1 0.3 0.2
平衡浓度(mol/L) 0.3 0.6 0
由于是可逆反应,则0.1<a<0.3、0<b<0.6、0<c<0.4,所以选项ACD均是不可能的,答案选B;
(3) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L) 0.5 1.5 0
转化浓度(mol/L) 0.2 0.6 0.4
平衡浓度(mol/L) 0.3 0.9 0.4
①2min内v(NH3)=0.4mol/L÷2min=0.2mol/(L·min);
②相同条件下压强之比是物质的量之比,也是气体的浓度之比,则平衡时容器的压强与起始时压强之比为![]() 。
。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】已知:lg C(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述不正确的是 ( )

A. 碳[C(s)]的燃烧热△H< -110.4kJ·mol-1
B. 1mol CuO分解生成Cu2O吸收73kJ的热量
C. 2Cu2O(s)+O2(g)=4CuO(s) △H=-292 kJ·mol-1
D. 足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)=Cu2O(s) +CO(g) △H= -35.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是
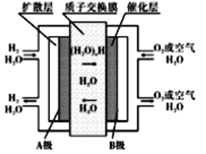
A. 可用一氧化碳代替图中氢气形成质子交换膜燃料电池
B. B极的电极反应式为O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole-时,通过质子交换膜的H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( )

①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
A. 1项 B. 2项
C. 3项 D. 4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )

A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修5:有机化学基础】芳香族化合物A是一种降血脂药物,A不能与Na反应。其合成路线如下:

已知:
I.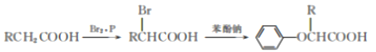
II.RCH==CH2![]() RCH2CH2Br
RCH2CH2Br
III.烃C的核磁共振氢谱只有两组峰,它的质谱图如图所示:

IV.K的结构具有对称性:I能发生银镜反应且1molI能与2molH2发生加成反应。试回答下列问题:
(1)烃C的化学名称为_______________________。
(2)H分子中含有的官能团名称为_____________;反应的条件为____________________。
(3)写出J与新制银氨溶液发生反应的化学方程式:______________________________________。
(4)反应④的化学方程式为:____________________________________________。
(5)符合下列3个条件的H的同分异构体有____种,其中氢原子共有五种不同环境的是(写结构简式)__________________________________________。
①能与FeCl溶液显色;②苯环上只有2个取代基;③1mol该物质最多可消耗1molNaHCO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 0.4 mol Cu2S 与足量稀硝酸反应,生成 Cu(NO3)2、S、NO 和 H2O,则参加反应的硝酸 中未被还原的硝酸的物质的量为
A.2 molB.1 molC.1.6 molD.2.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH1=-a kJ·mol-1
②CO(g)+![]() O2(g)===CO2(g) ΔH2=-b kJ·mol-1
O2(g)===CO2(g) ΔH2=-b kJ·mol-1
③H2(g)+![]() O2(g)===H2O(g) ΔH3=-c kJ·mol-1
O2(g)===H2O(g) ΔH3=-c kJ·mol-1
④H2(g)+![]() O2(g)===H2O(l) ΔH4=-d kJ·mol-1 下列叙述正确的是
O2(g)===H2O(l) ΔH4=-d kJ·mol-1 下列叙述正确的是
A. 由上述热化学方程式可知ΔH3<ΔH4
B. H2的燃烧热为d kJ·mol-1
C. CH3OH(g)===CO(g)+2H2(g) ΔH=( a- b-2c)kJ·mol-1
D. 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为![]() mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com