
【题目】向体积为2L的密闭容器中加入2molSO2和1molO2 , 进行可逆反应2SO2+O22SO3 反应2min后,测得O2的物质的量为0.8mol,则加热
(1)2min内,SO2的物质的量减少了 , SO3的物质的量增加了
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
【答案】
(1)0.4mol;0.4mol
(2)0.05mol/(L?min)
(3)0.1mol/(L?min)
【解析】解:(1)反应2min后,测得O2的物质的量为0.8mol,则氧气的物质的量变化为:1mol﹣0.8mol=0.2mol,根据反应方程式2SO2+O22SO3可知,二氧化硫减少的物质的量为:0.2mol×2=0.4mol,三氧化硫增加的物质的量为:0.2mol×2=0.4mol,所以答案是:0.4mol;0.4mol;(2)用O2的浓度变化来表示该反应的反应速率为:v(O2)= ![]() =0.05mol/(Lmin),所以答案是:0.05mol/(Lmin);(3)反应速率之比等于化学计量数之比,则v(SO3)=2v(O2)=2×0.05mol/(Lmin)=0.1mol/(Lmin),所以答案是:0.1mol/(Lmin).
=0.05mol/(Lmin),所以答案是:0.05mol/(Lmin);(3)反应速率之比等于化学计量数之比,则v(SO3)=2v(O2)=2×0.05mol/(Lmin)=0.1mol/(Lmin),所以答案是:0.1mol/(Lmin).
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
(1)Ⅰ.研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示.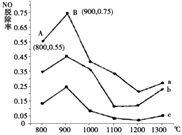
①曲线a中,NO的起始浓度为6×10﹣4 mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为mg/(m3s).
②曲线b对应的NH3与NO的物质的量之比是 , 其理由是 .
③已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol
请写出用NH3脱除NO的热化学方程式
(2)Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下(Ce为铈元素):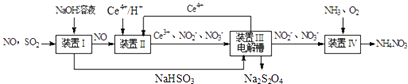
①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为 .
②装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如右图所示.其阴极的电极反应式为 . 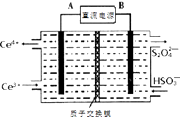
③按上述流程处理含有a mol SO2、b mol NO的雾霾(b>a),并制取Na2S2O4和NH4NO3 . 装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3﹣和Ce3+、装置Ⅳ中NO2﹣均全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2L.(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH=2的盐酸溶液100mL,要使它的pH升为3.
(1)若加入蒸馏水,应加mL(不考虑溶液体积变化,下同).
(2)若加入pH为4的盐酸溶液,应加mL.
(3)若加入0.001molL﹣1的氢氧化钠,应加mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物
②CH3COOH、HCl、H2CO3分别为一元酸、一元酸、二元酸
③CuSO4·5H2O、水银、烧碱、H2SO4均为化合物
④C60、C70、金刚石、石墨为四种单质
A.①③④ B.②③ C.②④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由基本有机化工原料A(C2H2)制备有机物D和聚异戊二烯的合成路线如图所示: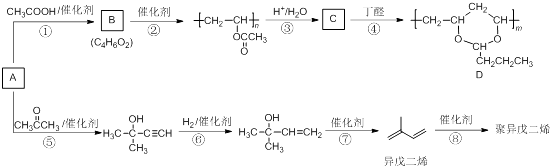
完成下列填空:
(1)上述转化步骤中与反应①的反应类型相同的是(填编号).
(2)m与n的关系为 .
(3)异戊二烯分子中最多有个原子共平面.
(4)在异戊二烯的同分异构体中,与A具有相同官能团且分子中有支链的有机物的名称是 .
(5)参照流程图中异戊二烯的合成路线,若把步骤⑤中的反应物丙酮改为乙醛,则经过反应⑤、⑥、⑦后得到的有机物是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用(选填编号),其理由是 . a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
(2).漂白性用如图所示装置(气密性良好)进行实验,观察到如下现象: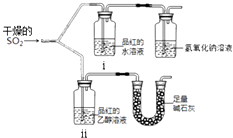
ⅰ中红色褪去、
ⅱ中无变化.
①足量碱石灰的作用是 .
②从实验中可知使品红的水溶液褪色的微粒可能是 .
(3)实验小组进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3﹣或SO32﹣ . 你认为这一结论是否正确 , 理由是 .
(4).还原性将SO2通入FeCl3溶液中,使其充分反应.
①SO2与FeCl3反应的离子方程式是 , 如何检验该反应所得含氧酸根离子 .
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32﹣ . 则②中红棕色变为浅绿色的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的浓度关系正确的是( )
A.1.0 mol/L Na2C2O4溶液中:c(OH﹣)═c(H+)+c(HC2O ![]() )+2c(H2C2O4)
)+2c(H2C2O4)
B.含等物质的量的NaHCO3和Na2CO3的溶液中:3c(Na+)=2[c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3)]
)+c(H2CO3)]
C.二元酸H2A在水中发生电离:H2A=H++HA﹣和HA﹣?H++A2﹣ , 则NaHA溶液中:c(Na+)>c(HA﹣)>c(OH﹣)>c(H+)
D.含有AgCl和AgI固体的悬浊液:c(Cl﹣)<c(I﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com