
����Ŀ��ʵ��С��Ϊ̽��SO2��Ư���Ժͻ�ԭ�ԣ����������ʵ�飮���������գ�
��1��ʵ�������������Ʒ�ĩ��������ȡ������������������������Һ��Ӧѡ����ѡ���ţ����������� �� a��98%Ũ���� b��70%���� c��10%ϡ����
��2����Ư��������ͼ��ʾװ�ã����������ã�����ʵ�飬�۲쵽��������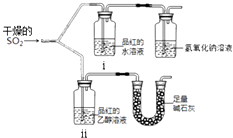
���к�ɫ��ȥ��
�����ޱ仯��
��������ʯ�ҵ������� ��
�ڴ�ʵ���п�֪ʹƷ���ˮ��Һ��ɫ���������� ��
��3��ʵ��С���һ��ʵ�����£�ȡ������ͬŨ�ȵ�Ʒ��ˮ��Һ����֧�Թ��У��ٷֱ��������Na2SO3�����NaHSO3���壬��֧�Թ��е�Ʒ�춼��ɫ�����ǵó����ۣ�ʹƷ����ɫ�����϶���HSO3����SO32�� �� ����Ϊ��һ�����Ƿ���ȷ �� ������ ��
��4������ԭ�Խ�SO2ͨ��FeCl3��Һ�У�ʹ���ַ�Ӧ��
��SO2��FeCl3��Ӧ�����ӷ���ʽ�� �� ��μ���÷�Ӧ���ú���������� ��
��ʵ���й۲쵽��Һ�ɻ�ɫ��Ϊ����ɫ������һ��ʱ�䣬��Ϊdz��ɫ��
��֪������ɫΪFeSO3��ī��ɫ�������FeCl3��Һ�γɵĻ��ɫ��Fe3+������SO32�� �� ����к���ɫ��Ϊdz��ɫ��ԭ����
���𰸡�
��1��b��98%Ũ������c��H+��С����Ӧ��10%������Һˮ�����߲���ʹSO2�ų�
��2����ֹ�����е�ˮ�������뢢�и���ʵ�飬���ն����������Ⱦ��H2SO3��HSO3����SO32��
��3������ȷ����ΪSO32�����Ӻ�HSO3�����Ӷ���ˮ������H2SO3
��4��2Fe3++SO2+2H2O��2Fe2++SO42��+4H+��ȡ������Ӧ���Һ�����������ữ����Ȼ�����������ɫ���������Һ�м�����SO42�������Һ�д���ƽ��FeSO3��s��Fe2+��aq��+SO32����aq����Fe3+����SO32������������ԭ��Ӧ��ʹƽ�����ƣ�ī��ɫ�����ܽ⣬��������dz��ɫFeSO4��Һ
���������⣺��1��ʵ�������������Ʒ�ĩ��������ȡ��������һ����70%���ᣬŨ��̫��������Ũ��С������Ӧ������Ũ��̫С����������������ˮ�����Զ��������ų�����ѡ b���ʴ�Ϊ��b��98%Ũ������c��H+��С����Ӧ��10%������Һˮ�����߲���ʹSO2�ų�����2���ٶ��������ж�������Ⱦ����������Ҫ�ü�ʯ�����գ�ͬʱ�����Է�ֹ�����е�ˮ�ݽ���װ�ã���ʵ��������ţ�����ͼ��������ʯ�ҵ������Ƿ�ֹ�����е�ˮ�������뢢�и���ʵ�飬���ն����������Ⱦ���ʴ�Ϊ����ֹ�����е�ˮ�������뢢�и���ʵ�飬���ն����������Ⱦ���ڱȽ�Ʒ���ˮ��Һ���Ҵ���Һ��֪��Ʒ����ɫ����Ϊ��ˮ�Ĵ��ڣ�����������ˮ��Ӧ���������ᣬ������Ϊ��Ԫ���ᣬ�ܷ����������룬����HSO3����SO32�� �� ����ʹƷ����ɫ�����ӿ�����H2SO3��HSO3����SO32�� �� �ʴ�Ϊ��H2SO3��HSO3����SO32������3��������Ϊ��Ԫ���ᣬNa2SO3�����NaHSO3��������ˮ�õ���Һ����ˮ����������Ӻ�������������Ӷ�ˮ������������ᣬ����ʹƷ����ɫ�����϶���HSO3����SO32����һ˵������ȷ�����ʴ�Ϊ������ȷ�� ��ΪSO32�����Ӻ�HSO3�����Ӷ���ˮ������H2SO3����4����SO2��FeCl3��Ӧ������������Ӻ��������ӣ���Ӧ�����ӷ���ʽΪ2Fe3++SO2+2H2O��2Fe2++SO42��+4H+ �� �ñ����Ӽ�����������ӣ�����Ϊȡ������Ӧ���Һ�����������ữ����Ȼ�����������ɫ���������Һ�м�����SO42�� �� �ʴ�Ϊ��2Fe3++SO2+2H2O��2Fe2++SO42��+4H+��ȡ������Ӧ���Һ�����������ữ����Ȼ�����������ɫ���������Һ�м�����SO42��������Һ�ɺ���ɫΪFeSO3��ī��ɫ�������FeCl3��Һ�γɵĻ��ɫ����Ϊdz��ɫ��ӦΪ�������ӣ���˵�������ӱ�����������ӻ�ԭ�����Ժ���ɫ��Ϊdz��ɫ��ԭ���ǻ��Һ�д���ƽ��FeSO3��s��Fe2+��aq��+SO32����aq����Fe3+����SO32������������ԭ��Ӧ��ʹƽ�����ƣ�ī��ɫ�����ܽ⣬��������dz��ɫFeSO4��Һ���ʴ�Ϊ�����Һ�д���ƽ��FeSO3��s��Fe2+��aq��+SO32����aq����Fe3+����SO32������������ԭ��Ӧ��ʹƽ�����ƣ�ī��ɫ�����ܽ⣬��������dz��ɫFeSO4��Һ��
��1��ʵ�������������Ʒ�ĩ��������ȡ��������һ����70%���ᣬŨ��̫��������Ũ��С������Ӧ������Ũ��̫С����������������ˮ�����Զ��������ų�����2���ٶ��������ж�������Ⱦ����������Ҫ�ü�ʯ�����գ�ͬʱ�����Է�ֹ�����е�ˮ�ݽ���װ�ã���ʵ��������ţ��ڱȽ�Ʒ���ˮ��Һ���Ҵ���Һ��֪��Ʒ����ɫ����Ϊ��ˮ�Ĵ��ڣ�����������ˮ��Ӧ���������ᣬ������Ϊ��Ԫ���ᣬ�ݴ˷�������3��������Ϊ��Ԫ���ᣬNa2SO3�����NaHSO3��������ˮ�õ���Һ����ˮ����������Ӻ�������������Ӷ�ˮ������������ᣬ�ݴ˷�������4����SO2��FeCl3��Ӧ������������Ӻ��������ӣ��ñ����Ӽ�����������ӣ�ע��Ҫ�ų��������ӵĸ��ţ�����Һ�ɺ���ɫΪFeSO3��ī��ɫ�������FeCl3��Һ�γɵĻ��ɫ����Ϊdz��ɫ��ӦΪ�������ӣ���˵�������ӱ�����������ӻ�ԭ���ݴ˷�����


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ������,����ֻ����Na+��K+��Ca2+��Cl-��NO3��,��֪����Na+��K+��Ca2+��NO3����Ũ�Ⱦ�Ϊ0.1 mol��L-1,��Cl-�����ʵ���Ũ��Ϊ(����)
A. 0.1 mol��L-1 B. 0.3 mol��L-1 C. 0.2 mol��L-1 D. 0.4 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ����ڷ�Ӧ��14CuSO4+5FeS2+12H2O��7Cu2S+5FeSO4+12H2SO4 �� �ڸ÷�Ӧ�У� ��
A.�����е�SO ![]() ��һ��������������
��һ��������������
B.5molFeS2������Ӧ����10mol����ת��
C.����������Ӧ�ͷ�����ԭ��Ӧ��FeS2֮��Ϊ7��3
D.14mol CuSO4������5molFeS2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ϊ2L���ܱ������м���2molSO2��1molO2 �� ���п��淴Ӧ2SO2+O22SO3 ��Ӧ2min���O2�����ʵ���Ϊ0.8mol�������
��1��2min�ڣ�SO2�����ʵ��������� �� SO3�����ʵ���������
��2������O2��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���V��O2��=
��3������SO3��Ũ�ȱ仯����ʾ�÷�Ӧ�ķ�Ӧ���ʣ���V��SO3��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���A�ͱ���Ϊԭ�Ϻϳ�һ��ҽҩ�м���E��·�����£�
���������գ�
��1����֪A�ķ���ʽΪC2H2O3 �� �ɷ���������Ӧ���Ҿ������ԣ�д��A����������Ӧ�Ļ�ѧ����ʽ ��
��2���л���B  �Т١��ڡ���3����OH��������ǿ������˳��Ϊ��д��B�����Na2CO3��Һ��Ӧ�Ļ�ѧ����ʽ ��
�Т١��ڡ���3����OH��������ǿ������˳��Ϊ��д��B�����Na2CO3��Һ��Ӧ�Ļ�ѧ����ʽ ��
��3��������D����2����B���ɵĺ���3����Ԫ���Ļ����D�Ľṹ��ʽ�� ��
��4����֪�����ƺͱ�����ȣ����ױ������������л���B�Ʊ�  ��д����Ӧ������Ӧ������������Լ��ͷ�Ӧ���� ��
��д����Ӧ������Ӧ������������Լ��ͷ�Ӧ���� ��
��5��д����������������E������ͬ���칹��Ľṹ��ʽ�������������칹�����ٱ�����ֻ��2��λ��δ��ȡ������������λ���ϵ���ԭ�ӻ�ѧ������ͬ��
����FeCl3��Һ��������ɫ��Ӧ��
���ܷ���������Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥNO��NO2��N2O4�Դ�������Ⱦ��������NaOH��Һ�������մ�������Ӧ����ʽ��2NO2+2NaOH=NaNO3+NaNO2+H2O��NO2 +NO+2NaOH=2NaNO2+H2O ��������a mol NO��b mol NO2�� c mol N2O4��ɵĻ������ǡ�ñ� V L NaOH ��Һ���գ�������ʣ�ࣩ����� NaOH ��Һ�����ʵ���Ũ��Ϊ( ) mol/L
A. ��a+b+c��/V B. 2��a+b+c��/3V C. ��b+2c��/V D. ��a+b+2c��/V
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֦��ṹ��ʽ��ͼ������˵����ȷ���ǣ� �� 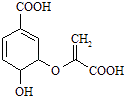
A.����ʽΪC10H8O6
B.�����к���2�ֹ�����
C.�����Ҵ������ᷴӦ���ҷ�Ӧ������ͬ
D.1mol��֦��������3mol NaOH�����кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL0.1mol/L NaOH��Һ�м���0.1mol/L��һԪ��HA����ҺpH�ı仯������ͼ��ʾ������˵����ȷ���ǣ� �� 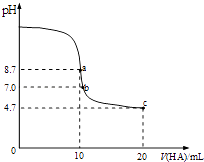
A.a����Һ�У�c��Na+����c��A������c��H+����c��HA��
B.a��c������Һ��ˮ�ĵ���̶���ͬ
C.b����Һ�У�c��Na+��=c��A����+c��HA��
D.c����Һ�У�c��A������c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵ���Һ�����������Լ���Ҳ������ɫ��Ӧ���ܽ���������������(����)
A.AgNO3 NaCl BaCl2 NaOH
B.K2CO3 KHCO3 HCl H2SO4
C.Na2CO3 HCl Ba(NO3)2 KCl
D.KNO3 NaCl BaCl2 (NH4)2SO4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com