
【题目】某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3—,已知其中Na+、K+、Ca2+、NO3—的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为( )
A. 0.1 mol·L-1 B. 0.3 mol·L-1 C. 0.2 mol·L-1 D. 0.4 mol·L-1
科目:高中化学 来源: 题型:
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 ( )
A. ②④⑥ B. ①③⑤ C. ①②④ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f为六种原子序数依次增大前20号主族元素,a、b、c、d位于同周期,b、f位于同主族,其中a、b、f 为金属元素,c的最外层电子数是其次外层电子数的3倍,c与f 的原子序数和是e的2倍。下列说法错误的是
A. 原子半径a>b>c>d
B. 最简单气态氢化物的稳定性e<c<d
C. 最高价氧化物对应的水化物的碱性f>b
D. fc2、ec2两种化合物中c的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
(1)Ⅰ.研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示.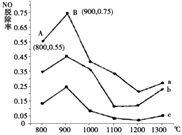
①曲线a中,NO的起始浓度为6×10﹣4 mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为mg/(m3s).
②曲线b对应的NH3与NO的物质的量之比是 , 其理由是 .
③已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol
请写出用NH3脱除NO的热化学方程式
(2)Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下(Ce为铈元素):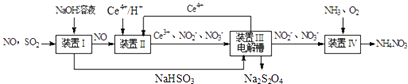
①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为 .
②装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如右图所示.其阴极的电极反应式为 . 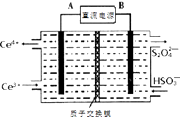
③按上述流程处理含有a mol SO2、b mol NO的雾霾(b>a),并制取Na2S2O4和NH4NO3 . 装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3﹣和Ce3+、装置Ⅳ中NO2﹣均全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2L.(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】良好的生态环境可以提升生活质量.
①近几年来,我国多次出现大范围雾霾天气,许多城市发布PM2.5重度污染警报.下列行为能缓解城市大气中PM2.5浓度的是(填字母).
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.大面积开发土建项目
②垃圾无害化处理有利于保护生态环境.下列有关生活垃圾的处理合理的是
(填字母).
a.废旧塑料露天焚烧 b.用厨房垃圾生产沼气 c.废旧电池就地填埋
③选择环保的装修材料可以有效地减少居室污染.劣质胶合板释放的主要污染物是(填字母).
a.NO b.CO c.甲醛
④光化学烟雾主要是氮氧化物所造成的.工业上可用氨气在催化剂作用下与之反应生成对空气无污染的物质.请写出氨气与二氧化氮反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作还原剂的是( )
A. 2Na+2H2O=2NaOH+H2↑B. Cl2+H2O=HCl+HClO
C. 2F2+2H2O=4HF+O2D. SO2+H2O=H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程从海带中提取碘单质。
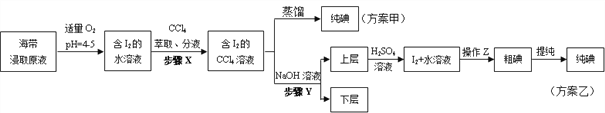
已知:3I2+6NaOH=5NaI+NaIO3+3H2O,根据以上流程,判断下列说法不正确的是( )
A. 方案甲采用蒸馏法不合理主要由于碘易升华,会导致碘的损失
B. 步骤X中,萃取后分液漏斗内观察到的现象为液体分上下两层,上层呈紫红色
C. 步骤Y中,应控制NaOH溶液的浓度和体积
D. 步骤Y的目的将碘转化成离子进入水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用(选填编号),其理由是 . a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
(2).漂白性用如图所示装置(气密性良好)进行实验,观察到如下现象: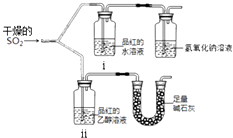
ⅰ中红色褪去、
ⅱ中无变化.
①足量碱石灰的作用是 .
②从实验中可知使品红的水溶液褪色的微粒可能是 .
(3)实验小组进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3﹣或SO32﹣ . 你认为这一结论是否正确 , 理由是 .
(4).还原性将SO2通入FeCl3溶液中,使其充分反应.
①SO2与FeCl3反应的离子方程式是 , 如何检验该反应所得含氧酸根离子 .
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色.
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32﹣ . 则②中红棕色变为浅绿色的原因是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com