
【题目】利用图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
B | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2溶液反应 | |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子半径逐渐减小,A与C的核电荷数之比为3: 4,能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A. X、Y、Z的稳定性逐渐减弱
B. X、Y、Z三种化合物的熔沸点逐渐降低
C. A、B、C、D只能形成5种单质
D. 由A、B、C、D四种元素组成的化合物有很多种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3—,已知其中Na+、K+、Ca2+、NO3—的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为( )
A. 0.1 mol·L-1 B. 0.3 mol·L-1 C. 0.2 mol·L-1 D. 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提溴:浓缩海水 ![]() 粗产品溴
粗产品溴 ![]() 溴蒸气
溴蒸气 ![]() 物质X
物质X ![]() 产品溴,下列说法错误的是( )
产品溴,下列说法错误的是( )
A.步骤①的主要反应为:Cl2+2Br﹣→Br2+2Cl﹣
B.物质X为HBrO
C.步骤②③的目的是富集溴元素
D.步骤②利用了溴易挥发的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在自来水蒸馏实验中,下列操作叙述不正确的是( )
A. 在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒碎瓷片
B. 将温度计水银球插到蒸馏烧瓶中的自来水中
C. 冷水应从冷凝管下口进,上口出
D. 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A. 外电路的电流方向为X![]() 外电路
外电路![]() Y
Y
B. 若两电极分别为Fe和碳棒,则X 为碳棒,Y 为Fe
C. X 极上发生的是还原反应,Y 极上发生的是氧化反应
D. 若两电极都是金属,则它们的活泼性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4 . 在该反应中( )
A.产物中的SO ![]() 有一部分是氧化产物
有一部分是氧化产物
B.5molFeS2发生反应,有10mol电子转移
C.发生氧化反应和发生还原反应的FeS2之比为7:3
D.14mol CuSO4能氧化5molFeS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2L的密闭容器中加入2molSO2和1molO2 , 进行可逆反应2SO2+O22SO3 反应2min后,测得O2的物质的量为0.8mol,则加热
(1)2min内,SO2的物质的量减少了 , SO3的物质的量增加了
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( ) 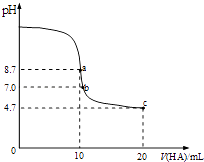
A.a点溶液中:c(Na+)>c(A﹣)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A﹣)+c(HA)
D.c点溶液中:c(A﹣)>c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com