
【题目】硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
(1)Ⅰ.研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示.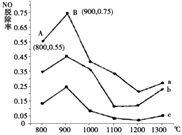
①曲线a中,NO的起始浓度为6×10﹣4 mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为mg/(m3s).
②曲线b对应的NH3与NO的物质的量之比是 , 其理由是 .
③已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol
请写出用NH3脱除NO的热化学方程式
(2)Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下(Ce为铈元素):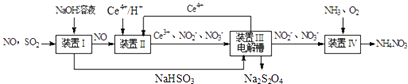
①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为 .
②装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如右图所示.其阴极的电极反应式为 . 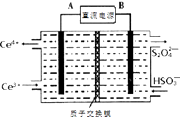
③按上述流程处理含有a mol SO2、b mol NO的雾霾(b>a),并制取Na2S2O4和NH4NO3 . 装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3﹣和Ce3+、装置Ⅳ中NO2﹣均全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2L.(用含a、b的代数式表示)
【答案】
(1)1.5×10﹣4;3:1;NH3与NO的物质的量的比值越大,NO脱除率越大;4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070kJ/mol
(2)3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+;2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O;5.6(3b﹣a)
【解析】解:(1)Ⅰ.①曲线a中,NO的起始浓度为6×10﹣4mg/m3 , A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8 s,该时间段内NO的脱除速率= ![]() =1.5×10﹣4mg/(m3s),所以答案是:1.5×10﹣4;②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,所以答案是:3:1;NH3与NO的物质的量的比值越大,NO脱除率越大;③已知在25℃,101kPa时:①N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol③N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol利用盖斯定律,将②×3﹣①×2﹣③×3可得4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol, 所以答案是:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol;(2)Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2﹣、NO3﹣等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4 , NO2﹣、NO3﹣等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+ , 所以答案是:3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+;②阴极发生还原反应,电极方程式为2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O,所以答案是:2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O;③amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3 , S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,由化合价升降总数相等可知4x+a=3b,x=
=1.5×10﹣4mg/(m3s),所以答案是:1.5×10﹣4;②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为1:3、3:1、4:1时,对应的曲线为c、b、a,故曲线b 对应NH3与NO的物质的量之比是3:1,所以答案是:3:1;NH3与NO的物质的量的比值越大,NO脱除率越大;③已知在25℃,101kPa时:①N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol③N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol利用盖斯定律,将②×3﹣①×2﹣③×3可得4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol, 所以答案是:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=﹣2070 kJ/mol;(2)Ⅱ.SO2、NO是大气污染物,通过氢氧化钠溶液吸收得到亚硫酸氢钠,一氧化氮不反应,通过装置Ⅱ加入Ce4+氧化还原反应得到Ce3+、NO2﹣、NO3﹣等,和亚硫酸氢钠混合,在电解池中通电电解得到Ce4+循环使用,获得Na2S2O4 , NO2﹣、NO3﹣等加入氨气和氧气在装置Ⅳ中发生反应得到NH4NO3产品,①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+ , 所以答案是:3Ce4++NO+2H2O═3Ce3++NO3﹣+4H+;②阴极发生还原反应,电极方程式为2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O,所以答案是:2HSO3﹣+2e﹣+2H+═S2O42﹣+2H2O;③amolSO2、bmolNO反应后分别生成Na2S2O4、NH4NO3 , S元素化合价由+4价降低到+3价,N元素化合价由+2价升高到+5价,设通入xmol氧气,由化合价升降总数相等可知4x+a=3b,x= ![]() ,则氧气的体积为
,则氧气的体积为 ![]() mol×22.4L/mol=5.6(3b﹣a)L,所以答案是:5.6(3b﹣a).
mol×22.4L/mol=5.6(3b﹣a)L,所以答案是:5.6(3b﹣a).
【考点精析】关于本题考查的反应热和焓变和化学平衡的计算,需要了解在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】加碘食盐中通常加入的是KIO3 , 该物质在酸性条件下表现出较强的氧化性,可以和碘化物、亚硫酸盐等还原性物质发生反应.
(1)写出KIO3与KI在稀硫酸介质中发生反应的离子方程式
(2)为测定菜加碘盐中碘元素的含量,某学生甲设计了如下实验: A.准确称取w g食盐,使其完全溶解在适量的蒸馏水中;
B.用稀硫酸酸化所得溶液,加入过量的KI溶液,使其充分反应;
C.以为指示剂,逐滴加入物质的量浓度为2.0×10﹣3mol/L的硫代硫酸钠溶液10.0mL,恰好完全反应,判断反应完全的实验现象为 , 则该加碘盐样品中碘元素的含量为mg/Kg(用含w的代数式表示).
(已知:I2+2S2O32﹣═2I﹣+S4O62﹣)
(3)某学生乙又进行了下列实验: A.准确称取1.0g纯净的NaCl,加3mL蒸馏水配成溶液,溶液为无色;
B.滴入5滴指示剂和1mL 0.lmol/L KI溶液,充分振荡,溶液不变化;
C.继续滴加l滴1mol/L的硫酸溶液,充分振荡,溶液变蓝色
推测实验中产生蓝色现象的原因,用离子方程式表示
根据学生乙的实验结果,请对学生甲的实验结果进行分(偏大、偏小、正确),其原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子半径逐渐减小,A与C的核电荷数之比为3: 4,能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A. X、Y、Z的稳定性逐渐减弱
B. X、Y、Z三种化合物的熔沸点逐渐降低
C. A、B、C、D只能形成5种单质
D. 由A、B、C、D四种元素组成的化合物有很多种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA
B.制取标准状况下22.4 L Cl2 , 需转移的电子数为2NA
C.2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA
D.标准状况下3.36 L HF里含有的原子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱. 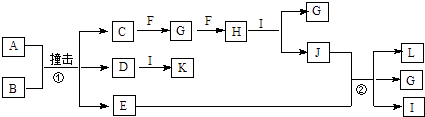
(1)F的化学式为 .
(2)K的电子式为 .
(3)写出反应①的化学方程式:
(4)写出反应②的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 根据分散质粒子的大小,可将分散系分为溶液、胶体和浊液
B. 胶体中分散质粒子的直径通常大于100nm
C. 溶液一定是均一、稳定的混合物
D. 向沸腾的蒸馏水中逐滴加入适里FeCl3饱和溶液, 继续煮沸至液体呈红褐色,可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3—,已知其中Na+、K+、Ca2+、NO3—的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为( )
A. 0.1 mol·L-1 B. 0.3 mol·L-1 C. 0.2 mol·L-1 D. 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用如下的方法从海水中提溴:浓缩海水 ![]() 粗产品溴
粗产品溴 ![]() 溴蒸气
溴蒸气 ![]() 物质X
物质X ![]() 产品溴,下列说法错误的是( )
产品溴,下列说法错误的是( )
A.步骤①的主要反应为:Cl2+2Br﹣→Br2+2Cl﹣
B.物质X为HBrO
C.步骤②③的目的是富集溴元素
D.步骤②利用了溴易挥发的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2L的密闭容器中加入2molSO2和1molO2 , 进行可逆反应2SO2+O22SO3 反应2min后,测得O2的物质的量为0.8mol,则加热
(1)2min内,SO2的物质的量减少了 , SO3的物质的量增加了
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com