
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA
B.制取标准状况下22.4 L Cl2 , 需转移的电子数为2NA
C.2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA
D.标准状况下3.36 L HF里含有的原子总数为0.3NA
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少Na2S2O5,并探究SO2的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题。
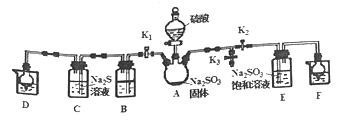
(1)向A中滴加的硫酸最好选用______(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是___________.
(3)装入药品后,打开K1、K2、K3并从K3处通入一段时间的N2,其目的是______,N2充满装置后再关闭K1、K3,打开K2,滴入硫酸后E中有Na2S2O5晶体析出,装置E中的反应方程式为_____
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有_____溶液,若B中所装溶液为酸性KMnO4溶液,B中发生反应的离子方程式为______,B中紫色完全褪去后,继续滴加硫酸,则装置C中观察到的现象是__________。
(5)若B中为新制的氯水,将SO2通入其中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论)
仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,对应原子的质子数之和为16,对应单质爱常温下均为气体。三种单质两两化合,可发生如图转化:已知1个B分子中含有的Z原子数比C分子中少1,B、C分子中均含有10个电子。下列说法正确的是
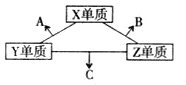
A. 原子半径:X>Y>Z
B. 非金属性:Y>X>Z
C. 沸点:A>B>C
D. B与C分子中所含的化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f为六种原子序数依次增大前20号主族元素,a、b、c、d位于同周期,b、f位于同主族,其中a、b、f 为金属元素,c的最外层电子数是其次外层电子数的3倍,c与f 的原子序数和是e的2倍。下列说法错误的是
A. 原子半径a>b>c>d
B. 最简单气态氢化物的稳定性e<c<d
C. 最高价氧化物对应的水化物的碱性f>b
D. fc2、ec2两种化合物中c的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4 , 在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( ) 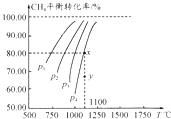
A.上述反应的△H<0
B.压强P1>P2>P3>P4
C.1100℃时该反应的平衡常数约为1.64
D.压强为P4时,y点的v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
(1)Ⅰ.研究发现利用NH3可消除硝酸尾气中的NO污染.NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示.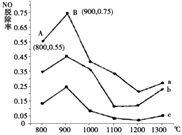
①曲线a中,NO的起始浓度为6×10﹣4 mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为mg/(m3s).
②曲线b对应的NH3与NO的物质的量之比是 , 其理由是 .
③已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.0kJ/mol
请写出用NH3脱除NO的热化学方程式
(2)Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下(Ce为铈元素):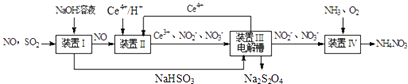
①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为 .
②装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如右图所示.其阴极的电极反应式为 . 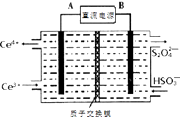
③按上述流程处理含有a mol SO2、b mol NO的雾霾(b>a),并制取Na2S2O4和NH4NO3 . 装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3﹣和Ce3+、装置Ⅳ中NO2﹣均全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2L.(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作还原剂的是( )
A. 2Na+2H2O=2NaOH+H2↑B. Cl2+H2O=HCl+HClO
C. 2F2+2H2O=4HF+O2D. SO2+H2O=H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH=2的盐酸溶液100mL,要使它的pH升为3.
(1)若加入蒸馏水,应加mL(不考虑溶液体积变化,下同).
(2)若加入pH为4的盐酸溶液,应加mL.
(3)若加入0.001molL﹣1的氢氧化钠,应加mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com