
【题目】在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4 , 在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( ) 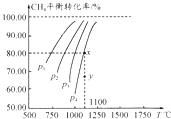
A.上述反应的△H<0
B.压强P1>P2>P3>P4
C.1100℃时该反应的平衡常数约为1.64
D.压强为P4时,y点的v正<v逆
【答案】C
【解析】解:A、从图象分析,随温度升高转化率增大,正反应吸热,△H>0,故A错误;B、压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故P4>P3>P2>P1 , 故B错误;
C、反应 CH4(g)+CO2(g)2CO(g)+2H2(g),
起始(mol/L)0.1 0.1 00
变化(mol/L)0.08 0.08 0.160.16
平衡(mol/L)0.02 0.02 0.160.16
平衡常数K= ![]() =1.64,故C正确;
=1.64,故C正确;
D、在y点,甲烷的转化率小于平衡时的转化率,平衡正向移动,V正>V逆 , 故D错误.
故选C.
A、随温度的升高转化率增大;
B、增大压强,平衡向气体体积减小的方向移动;
C、利用三段式计算出平衡时的浓度求算;
D、y点时甲烷的转化率小,平衡正向移动.


科目:高中化学 来源: 题型:
【题目】实验室制氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑下列说法错误的是( )
MnCl2+2H2O+Cl2↑下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移电子的物质的量为2 mol
C. 每消耗1 mol MnO2,起还原剂作用的HCl为4 mol
D. 生成的Cl2中含有HCl杂质,用饱和食盐水除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以验证非金属性的变化规律。

(1)仪器A的名称为_____________________,干燥管D的作用是______________________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、_______、_______,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( ) 
A.通入O2的电极反应式为:O2+4e﹣+2H2O═4OH﹣
B.电池内部H+由正极渗过交换膜向负极移动
C.甲醇在正极发生反应,电流经过外电路流向负极
D.注入CH3OH的电极反应式为:CH3OH+H2O﹣6e﹣═CO2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA
B.制取标准状况下22.4 L Cl2 , 需转移的电子数为2NA
C.2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA
D.标准状况下3.36 L HF里含有的原子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A. 空气、硫酸铜、硫酸B. 水、空气、纯碱
C. 氧化铁、胆矾、熟石灰D. 硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 根据分散质粒子的大小,可将分散系分为溶液、胶体和浊液
B. 胶体中分散质粒子的直径通常大于100nm
C. 溶液一定是均一、稳定的混合物
D. 向沸腾的蒸馏水中逐滴加入适里FeCl3饱和溶液, 继续煮沸至液体呈红褐色,可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用途广泛,但在使用时,一般会产生氯化氢.工业上可用O2将HCl转化为Cl2 , 以提高效益,减少污染.反应为:O2+4HCl ![]() 2Cl2+2H2O
2Cl2+2H2O 
完成下列填空:
(1)该反应化学平衡常数K的表达式为;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图1所示,则正反应是反应(填“吸热”或者“放热”).
(2)上述实验中若压缩体积使压强由P0增大至P1 , 在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由:
(3)该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10﹣3mol,则此时容器中的n(HCl)=mol.
(4)对该反应达到平衡后,以下分析正确的是(选填编号).a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5)氯元素能形成多种离子.在水溶液中1molCl﹣、1mol ClOx﹣(x=1,2,3,4)能量的相对大小如图2所示,写出B→A+C反应的热化学方程式(用离子符号表示);若有1.5molB发生反应,转移电子mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com