
【题目】实验室制氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑下列说法错误的是( )
MnCl2+2H2O+Cl2↑下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移电子的物质的量为2 mol
C. 每消耗1 mol MnO2,起还原剂作用的HCl为4 mol
D. 生成的Cl2中含有HCl杂质,用饱和食盐水除去
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3 , 并探究NCl3的漂白性.NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为﹣40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
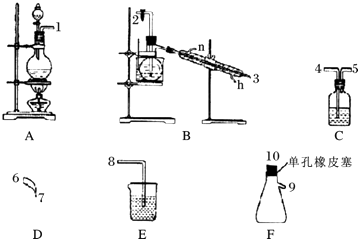
回答下列问题:
(1)根据实验目的,接口连接的顺序为1﹣﹣﹣2﹣3﹣6﹣7﹣﹣
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为 .
(3)A装置中发生反应的离子方程式为 .
(4)B装置中发生反应的化学方程式为 , 当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 .
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50﹣60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ①和④ D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少Na2S2O5,并探究SO2的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题。
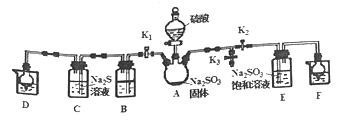
(1)向A中滴加的硫酸最好选用______(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是___________.
(3)装入药品后,打开K1、K2、K3并从K3处通入一段时间的N2,其目的是______,N2充满装置后再关闭K1、K3,打开K2,滴入硫酸后E中有Na2S2O5晶体析出,装置E中的反应方程式为_____
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有_____溶液,若B中所装溶液为酸性KMnO4溶液,B中发生反应的离子方程式为______,B中紫色完全褪去后,继续滴加硫酸,则装置C中观察到的现象是__________。
(5)若B中为新制的氯水,将SO2通入其中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论)
仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 .
A.C(s)+H2O(g)=CO(g)十H2(g)△H>O
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<O
C.2H2(g)+O2(g)=2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为: .
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为 . 通过一段时间后,向所得溶液中加入0.2molCu0粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 .
(4)0.2mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出433kJ热量,其燃烧热的热化学方程式为 . 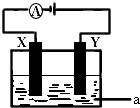
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为分子式为C7H8的芳香烃根据下面的反应路线及所给信息填空. 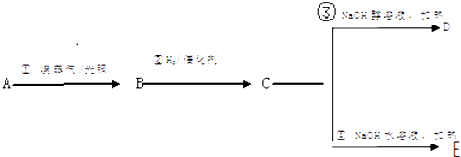
(1)A的名称是 .
(2)①的反应类型是;③的反应类型是 .
(3)简述B中卤素原子的检验方法
(4)反应①的化学方程式是 反应③的化学方程式是
反应④的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍原子比铝原子少1个电子层,最外层电子数也比铝原子少1,在周期表中铍和铝的位置关系存在有“对角线”关系的元素性质存在相似性。下列关于铍的判断不正确的是( )
A. Be能在空气中燃烧 B. BeO熔点较低
C. BeCl2是共价化合物 D. Be(OH)2具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4 , 在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( ) 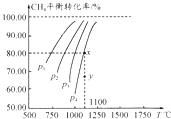
A.上述反应的△H<0
B.压强P1>P2>P3>P4
C.1100℃时该反应的平衡常数约为1.64
D.压强为P4时,y点的v正<v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com