
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A. “对电极”是负极
B. “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O
C. 传感器工作时H+由工作电极移向对电极
D. 对电极的材料可能为活泼金属锌
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
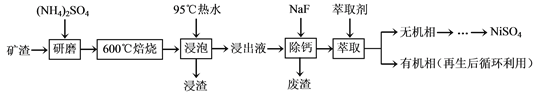
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酯增塑剂H及某医药中间体F的一种合成路线如下(部分反应条件略去):

已知: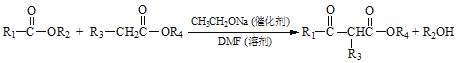
试回答下列问题:
(1)F中官能团名称为________;反应②的试剂和条件是_________________。
(2)Y的名称是_______;根据“绿色化学”原理,反应④的原子利用率为_______%。(保留小数点后一位)
(3)写出反应⑤的化学方程式_______________________。
(4)与C具有相同官能团且官能团数目相同的同分异构体还有_______种;⑥的反应类型是_______。
(5)B有多种同分异构体,其中在核磁共振氢谱上只有2个峰的结构简式为_________。
(6)利用以上合成路线的信息,设计一条以苯甲酸乙酯和乙醇为原料合成 的路线_______。(无机试剂任选)
的路线_______。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国防、工农业等领域发挥着重要作用。工业以甲烷为原料生产氨气的过程如下:![]()
(1)过程Ⅰ中,有关化学反应的能量变化如下图所示

反应①为___________(“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式是________________。
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ )溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)![]() [Cu(NH3)3]CH3COOCO(1),
[Cu(NH3)3]CH3COOCO(1), ![]()
①N元素在周期表中的位置为__________,NH3的电子式为__________。
②所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是__________(选填字母)。
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
(3)合成NH3的反应为放热反应,如果该反应平衡时,只改变一个条件,再次达到新平衡时,平衡常数K值变大。关于该反应的说法正确的是__________(填字母序号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大再减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小再增大
(4)400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,加入催化剂,10分钟后反应达到平衡时N2转化率为60%。该温度下的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(5)一种直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是_____________。
②用该电池电解300mL的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素位于元素周期表第_______周期______族。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为____________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:________
□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
(3)工业制备PH3的流程如图所示。

①黄磷和烧碱溶液反应的化学方程式为_________,次磷酸的化学式为____________,次磷酸属于___________(填“一”“二”或“三”)元酸。
②若起始时有1molP4参加反应,则整个工业流程中共生成 ______ mol PH3.(不考虑产物的损失)
II.某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。

①a表示__________离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品。其中C为硫酸,则A表示_____________。E表示___________________。
②阳极的电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
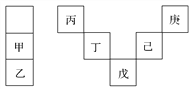
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com