
在反应aBrF3 + bH2O = cHBrO3 + dHBr + eHF + fO2↑中(a、b、c、d、e、f
是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol B.0.2mol C.0.3mol D.0.4mol
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.蛋白质的水解可用于分离和提纯蛋白质
B.丙烯酸甲酯可通过缩聚反应生成高分子化合物
C.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
 |
D.有机物 的核磁共振氢谱有两个峰,且峰面积之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.02 mol Na别投入到盛有100 mL水、100 mL 1mol 盐酸、100 mL 1mol
盐酸、100 mL 1mol 硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )。
硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )。
A.三个烧杯中一定均会发生的离子反应有:2Na+2H2O==2Na++2OH—+H2↑
B.三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些
C.Z烧杯中一定会有沉淀生成,但沉淀不是单质铜
D.三个烧杯中生成氢气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9 ~ 10-7m之间
B.胶体是一种均一、稳定的混合物
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Al(OH)3胶体能够吸附水中悬浮的固体颗粒沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对离子方程式书写的评价正确的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 将铝粉加入含氢氧化钠溶液中: 2Na++2OH-+2Al+H2O=2Na++AlO2-+3H2↑ | 正确 |
| B | Na2O2与H2O反应: Na2O2+H2O===2Na++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | 碳酸氢钠与醋酸反应: HCO3-+H+= H2O+CO2↑ | 正确 |
| D | 向FeCl3溶液中滴加足量氨水: Fe3++3OH-=== Fe(OH)3↓ | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量,提示:CaCl2,一种中性干燥剂)。
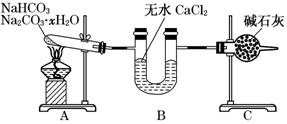
(1)A装置的作用是___________________________________________________。
(2)B装置的作用是___________________________________________________。
(3)C装置的作用是__________________________________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为______。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进______ 。为什么?______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
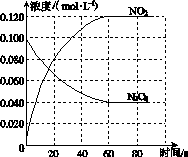
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com