
【题目】胆矾(CuSO45H2O)高温时发生反应:2CuSO45H2O![]() 2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
A.可用于胆矾分解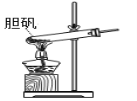
B.可用于检验产物是否含H2O 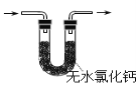
C.可用于收集O2 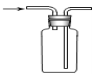
D.可用于吸收胆矾分解的SO2 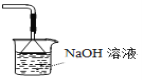
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.0.1molL-1NaOH溶液与0.2molL-1CH3COOH溶液等体积混合后:c(CH3COOH)+c(CH3COO-)=0.1molL-1
B.常温下,将CH3COONa和HCl两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH)
C.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③
D.25℃时,pH=a的盐酸与pH=b的Ba(OH)2溶液等体积混合后,恰好完全反应,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4LH2O含有的分子数为NA
B. 标准状况下,22.4LCO2和O2混合气体中含氧原子数为2NA
C. 常温常压下,7.8g Na2O2固体中含有的阴离子数为0.2 NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质![]() 括号内物质为杂质
括号内物质为杂质![]() ,所选用的试剂和分离方法都正确的是( )
,所选用的试剂和分离方法都正确的是( )
选项 | 物质 | 除杂试剂 | 分离方法或操作 |
A | 乙醇 | 无水 | 充分反应后蒸馏 |
B | 苯 | NaOH溶液 | 振荡静置后过滤 |
C | NaCl固体 | 水 | 高温溶解、降温结晶 |
D |
| 饱和 | 充分浸泡后过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,b与d的最外层电子数之和为a与c最外层电子数之和的四倍。下列叙述不正确的是
A. 原子半径:c>d>a
B. d的氧化物对应的水化物酸性均比b的强
C. a、b、d三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R、Q原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的0.1mol/L水溶液pH如下表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是

A. W和Q形成的化合物只含有离子键
B. Y和Z的氢化物沸点:Y<Z
C. 离子半径:r(Q>r(R)>r(Z)
D. Y和Q氧化物的水化物酸性:Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
Ⅰ.含氯消毒剂在生产生活中有极其重要的作用。
(1)Cl2常用于自来水的杀菌消毒。Cl2溶于水后,溶液中具有氧化作用的含氯微粒除Cl2外还有______________。
(2)为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质。其原因:一是_________________________________ (用离子方程式和相应的文字解释),二是生成的Fe(OH)3胶体具有较强的吸附 性能,可吸附水中的悬浮杂质,并能形成沉淀,使水净化。
(3)KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。常用作消毒剂,其变化可以表示为:2KClO3+4HCl(浓) = 2KCl+2ClO2↑+Cl2↑+2H2O,若改变温度至70 ℃,发现KClO3和浓盐酸反应的氧化产物和还原产物均为二氧化氯气体,试写出反应的化学方程式:_______________________。
Ⅱ.铁的化合物高铁酸钠(Na2FeO4)是一种新型净水剂。
(1)高铁酸钠主要通过反应制取:2Fe(OH)3+3X+ 4NaOH=2Na2FeO4+3NaCl+ 5H2O,则X的化学式为_____________。
(2)高铁酸钠在水中可以发生反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
4Fe(OH)3+8OH-↑+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性。
Ⅲ.(1)H2O2可作为矿业废液消毒剂,有“绿色氧化剂”的美称。H2O2被称为“绿色氧化剂”的理由是________________________________。
(2)取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①加适量H2O2,紫红色褪去,并有气泡产生;
②加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③后通入足量SO2,发生反应:5SO2+2MnO4-+5Pb2++2H2O==5PbSO4↓+2Mn2++4H+。
则KMnO4、H2O2、PbO2氧化性由强到弱的顺序为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)

④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式___________。
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式___________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母)

A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________。
(6)为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5~10.5,试分析原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某可逆反应aA(g) ![]() bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
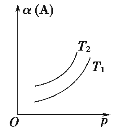
A.a>b+c
B.该反应的平衡常数随温度的升高而增大
C.T1﹤T2
D.该反应自发进行的温度是低温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com