
【题目】一定条件下,某可逆反应aA(g) ![]() bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
bB(s)+cC(g)自发进行并达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是
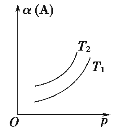
A.a>b+c
B.该反应的平衡常数随温度的升高而增大
C.T1﹤T2
D.该反应自发进行的温度是低温
科目:高中化学 来源: 题型:
【题目】胆矾(CuSO45H2O)高温时发生反应:2CuSO45H2O![]() 2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( )
A.可用于胆矾分解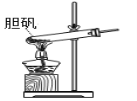
B.可用于检验产物是否含H2O 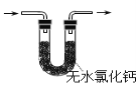
C.可用于收集O2 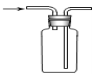
D.可用于吸收胆矾分解的SO2 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用废旧镀锌铁皮按下列流程制备七水硫酸锌(ZnSO4·7H2O)

相关信息如下:
①金属离子形成氢氧化物沉淀的pH,如图A所示。
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线如图B所示。

请回答:
(1)为提高镀锌铁皮中金属离子的浸出率,除了可适当增加硫酸的浓度,还可以采取的措施有:_______(任写一条)。
(2)步骤Ⅱ中需加入过量H2O2,请用离子方程式表示H2O2的作用________。
(3)步骤Ⅲ中调节pH范围为_______,调节pH宜选用的试剂为_______。
A.稀硫酸 B.氢氧化锌 C.氢氧化钠 D.氧化锌
(4)检验步骤Ⅲ所得滤液中是否含有Fe3+可采用的实验方法是_______。
(5)步骤Ⅳ需要用到下列所有操作:a.蒸发至溶液出现晶膜 b.在60℃蒸发溶剂 c.冷却至室温 d.在100℃蒸发溶剂 e.过滤
请给出上述操作的正确顺序______(操作可敢复使用)。
(6)步骤V中,某同学采用不同降温方式进行冷却结都,测得ZnSO4·7H2O颗粒大小分布如图所示。根据该实验结果,为了得到颗粒大小相对均的较大晶粒,宜选择______方式进行冷却结晶。
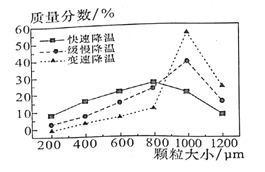
A.快速降温 B.级慢降温 C.变速降温
(7)ZnSO4可用于制备金属锌。用锌和高铁酸钾制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电池的总反应是2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。该电池正极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 测定等浓度的Na2CO3和Na2SO3溶液的pH,Na2CO3的pH大于Na2SO3溶液 | S的非金属性比C强 |
B | 常温下,用pH试纸测得:0.1mol·L-1NaHSO3溶液的pH约为5 |
|
C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
D | 向2mL0.1mol·L-1NaOH溶液中滴加3滴0.1mol·L-1MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol·L-1FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于如图所示各装置的叙述正确的是

A.装置①是原电池,总反应式是Cu+2Fe3+= Cu2++2Fe2+
B.装置①中,铁作正极,正极反应式为Fe3++e-= Fe2+
C.装置②可以减缓铁棒的腐蚀,此保护方法为牺牲阳极的阴极保护法
D.若用装置③精炼铜,则c极为粗铜,d极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.常温下,0.1 mol/L Na2S溶液中存在:c(OH﹣)=c(H+)+c(HS﹣)+c(H2S)
B.0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) >c(H+)
C.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH﹣)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.能自发进行的反应一定能迅速发生
B.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为判断反应能否自发进行的判据
D.反应2N2(g)+O2(g)=2N2O(g) ΔH=+163 kJ·mol-1在高温下可以自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com