
以下物质A、B、C、D均属于中学化学常见的物质,已知他们之间有如下转化关系,见图(部分反应中的H2O已略去),其中A、B、C均含有同一种元素。请填空
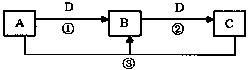
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则
①B的化学式是 ;
②工业上制取A的离子方程式为 。
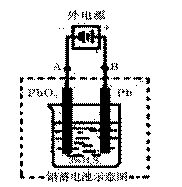
若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
Pb+PbO2 +4H++2SO42- 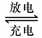 2PbSO4+2H2O 在完全放电耗尽PbO2和Pb时,
2PbSO4+2H2O 在完全放电耗尽PbO2和Pb时,
若按右图所示连接进行充电,充电一段时间后,则在A电极上生成
__________(填化学式)
充电完毕,铅蓄电池的正极是_______+2+_极(填“A”或“B”)
③B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降
除去,其原因是 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,
遇空气会变色,则反应③的化学方程式为 。
(3)若D是强碱,且A、B、C都含有同一种金属元素,则该金属元素在周期表中的位置是:
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
有镁铝混合物粉末10.2 g,将它溶于500 mL4 mol·L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2 mol·L-1氢氧化钠溶液的体积为
A. 1000 mL B. 500 mL C. 100 mL D. 1500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面四个反应①H2S+I2=S+2H++2I-② H2SO3+2H2S=3S↓+3H2O③ 2I-+Br2=I2+2Br-
④H2SO3+I2+H2O=4H++SO42-+2I- 判断Br-、I-、H2S和H2SO3的还原性由强到弱的顺序是
A. H2S>H2SO3>I->Br- B. Br->I->H2SO3>H2S
C. H2S>I->Br->H2SO3 D. I->Br->H2S>H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.向硅酸钠溶液中通入过量的CO2: SiO32—+CO2+H2O=H2SiO3↓+CO32—
C.用石墨作电极电解氯化镁:2Cl-+2H2O2OH-+H2↑+Cl2↑
D.向硝酸亚铁溶液中加入稀盐酸:3Fe2++4H++NO3-==3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)和二氧化氯(ClO2)都是高效水处理剂,其工业制备的反应原理分别为 2Fe(OH)3+3 KClO+4KOH=2K2FeO4+3KCl+5H2O
2KClO3+ Na2SO3 +H2SO4=2ClO2 + Na2SO4 + K2SO4+ H2O
下列说法中,正确的是
A.上述两个反应中, KClO3做氧化剂,KClO 做还原剂
B.ClO2做水处理剂原理和明矾相同
C.K2FeO4用于杀菌后其还原产物还可用作净水剂
D.制备等物质的量的K2FeO4和ClO2,转移的电子数之比为1 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
第4周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是 ( )
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.其氢氧化物的碱性比NaOH强 D.碳酸盐难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,观察到火焰呈黄色,下列各判断正确的是( )
A.只含有Na+
B.一定含有Na+,可能含有K+
C.既含有Na+,又含有K+
D.可能含有Na+,可能还会有K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com