
| A、1mol/LHNO3溶液 |
| B、水自身电离出C(H+)=10-9mol/L的盐酸 |
| C、pH为6的盐酸 |
| D、1×10-3mol/L NaCl溶液 |


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
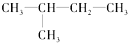 (8)
(8)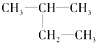 (9)CH2=CH-CH3(10)
(9)CH2=CH-CH3(10)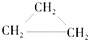
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离程度先增大,后又减小 |
| B、c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| C、溶液导电性先增强后减弱 |
| D、当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| P/P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3; Fe2O3 |
| B、Fe(OH)2; FeO |
| C、Fe(OH)3、Fe(OH)2;Fe3O4 |
| D、Fe2O3;Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| B、在非标准状况下,1mol任何气体的体积不可能是22.4L |
| C、标准状况下,22.4L酒精(CH3CH2OH)的分子数为NA |
| D、一定条件下,2.3g的Na完全与O2反应失去的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com