
下列有关电池的说法不正确的是( )
A.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
B.手机上用的锂离子电池属于二次电池
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
考点:
原电池和电解池的工作原理. .
专题:
电化学专题.
分析:
A.铜锌原电池放电时,电子从负极沿导线流向正极;
B.锂离子电池属于二次电池;
C.甲醇燃料电池属于原电池;
D.锌锰干电池中,锌易失电子而作负极.
解答:
解:A.铜锌原电池中,锌易失电子而作负极,铜作正极,电子从负极沿导线流向正极,故A错误;
B.锂离子电池中能循环使用,属于二次电池,故B正确;
C.燃料电池属于原电池,是将化学能转变为电能的装置,故C正确;
D.锌锰干电池中,锌易失电子发生氧化反应而作负极,故D正确;
故选A.
点评:
本题考查了原电池原理,明确原电池正负极的判断方法、电子的流向即可解答,难度不大.


科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.钠与水反应:
B.硅酸钠溶液与醋酸溶液混合: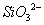 +
+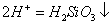
C.0.01mol/LNH4Al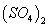 溶液与0.02mol/LBa(OH)2溶液等体积混合:
溶液与0.02mol/LBa(OH)2溶液等体积混合:
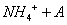 1
1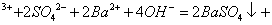 A1
A1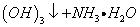
D.向次氯酸钙溶液通入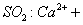
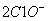 +
+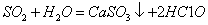
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应,不符合绿色化学概念的是 ( )
A.消除硫酸厂尾气排放:SO2+2NH3+H2O==(NH4)2SO3
B.消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH==2NaNO2+H2O
C.制CuSO4:2Cu+O2==2CuO,CuO+H2SO4==CuSO4+H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)== Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应M+N→P,如果温度每升高10℃,化学反应速度增大为原来的3倍,在10℃时,完成反应10%需81min,则在30℃时完成反应10%需要时间为( )
A.27min B.9min C.13.5min D.3min
查看答案和解析>>
科目:高中化学 来源: 题型:
将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间
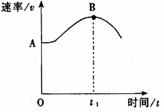 的关系可由右图表示。
的关系可由右图表示。
(1)写出离子反应方程式
(2)在下列因素中①H+的浓度 ②镁带的表面积 ③溶液的温度
④Cl-的浓度 能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段形成的原因 ;
(4)解释图中t1时刻后速率变小的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适当的条件,将反应Fe3++Ag═Fe2++Ag+设计成如图所示的原电池.下列判断正确的是( )
|
| A. | 反应开始时,石墨棒作阳极,银棒作阴极 |
|
| B. | 灵敏电流计的读数由小变大,再变小 |
|
| C. | 反应达化学平衡时,电流计读数最大 |
|
| D. | 反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1L0.1mol•L﹣1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)( )
|
| A. | 转移的电子数是1.204×1022 | B. | 阳极上产生112mLO2(标准状况) |
|
| C. | 溶液的浓度变化为0.08mol•L﹣1 | D. | 反应中有0.01molAg被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸,回答下列问题:
(1)醋酸的电离方程式是 ;下列哪些措施能够使醋酸溶液中c(H+) / c(CH3COO-) 增大的是
a. 升温 b. 通入HCl气体 c. 加入NaOH固体 d. 加入NaHSO4固体
(2)向100ml 0.1mol·L-1的醋酸中加入V ml 0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V 100ml (填“>”,“<”或“=”)
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中c(CH3COO-) / c(CH3COOH) = 18,则此时溶液的pH = (已知:CH3COOH的电离常数Ka=1.8×10-5)
(4)为测定食用醋中醋酸的含量(用每升食醋中所含醋酸的质量表示,单位:g/L),设计如下实验:a. 取20ml食醋于锥形瓶中,滴加2—3滴酚酞作指示剂。b. 向碱式滴定管中加入1mol·L-1的NaOH溶液,调整液面,并记下初始刻度。c. 开始滴定,并记录滴定终点时碱式滴定管的刻度,重复试验2—3次。
① 达到滴定终点时的现象是
② 经过测定,消耗NaOH溶液的体积为10ml,则该食醋中醋酸的含量是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com