
【题目】做焰色反应实验时用到的铂丝,应该用下列哪种溶液洗涤( )
A.稀HClB.浓HNO3C.稀HNO3D.稀H2SO4
科目:高中化学 来源: 题型:
【题目】有下列物质:
A.烧碱 B.硫酸 C.干冰 D.硫酸钡 E.纯碱 F.铁
(1)既不是电解质,也不是非电解质的是 。
(2)纯碱的电离方程式是 。
(3)烧碱溶液与稀硫酸混合,发生反应的离子方程式为______________________________。
(4)将干冰升华后所得的气体通入过量烧碱溶液中,发生反应的离子方程式为 。
(5)a、b、c、d分别是Na2CO3、BaCl2、HCl、AgNO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
反应物 | a+b | c+d | a+d | a+c | b+d |
现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
①b是 (用化学式填写)。
②写出a+c反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS=Na2Sx,电池结构如图所示。下列说法不正确的是( )

A. 放电时,Na作负极,反应式为Na-e-=Na+ B. 钠硫电池在常温下也能正常工作
C. 放电时Na+向正极移动 D. 当外电路通过0.25mol电子时消耗16g硫,则x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关微粒性质的比较中不正确的是
A. 离子半径:O2->Na+>Mg2+ B. 原子的未成对电子数:Mn>Ge>Br
C. 元素的第一电离能:O>N>C D. 元素的电负性:F>N>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将标准状况下的a L NH3(g)溶于0.1L水中,得到的氨水密度为b gcm﹣3,则该氨水的物质的量浓度是多少?(用a,b表示)
(2)已知反应:6NO + 4NH3= 5N2+ 6H2O。现有NO与NH3的混合物1mol,充分反应后所得产物中,经还原得到的N2比经氧化得到的N2多1.4g。若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量各是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1所示实验装置。
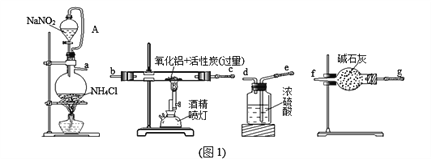
请回答:
(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,该离子方程式为____。
(2)图1装置中各仪器导管口连接的顺序是(可重复使用,用小写字母a→g填写):_______;
导管A的作用是_________________________________________。
(3)按要求连接好实验装置后,接下来的操作是_____________________。
(4)反应结束后,某同学用图2装置进行实验来测定 氮化铝样品的质量分数(实验中导管体积忽略不计)。
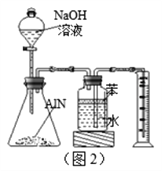
①氮化铝与过量的NaOH溶液反应生成氨气化学反应方程式为_______________;
② 集气瓶中的苯的作用是____________;集气瓶中的液体没有装满,则实验测得NH3的体积将__________(填“偏大” “偏小”或“不变”)。
③若实验中称取氮化铝样品的质量为8.0 g,测得氨气的体积2.8 L(标准状况),则样品中AlN的质量分数为___________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有________个未成对电子。Fe3+的电子排布式为_______________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1 mol乙醛分子中含有的σ键的数目为________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有__________个铜原子。锗也是一种半导体材料,Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是______________________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图:

镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com