
【题目】工业上通过反应“SiO2+2C![]() Si+2CO↑”制取单质硅,下列说法正确的是
Si+2CO↑”制取单质硅,下列说法正确的是
A. 自然界中硅元素均以SiO2形式存在
B. 高纯度晶体Si可用于制造光导纤维
C. 该反应条件下C的还原性比Si强
D. 标准状况下生成4.48 L CO时转移电子数为0.4×6.02×1023
【答案】D
【解析】工业上通过反应“SiO2+2C![]() Si+2CO↑”制取单质硅,下列说法正确的是
Si+2CO↑”制取单质硅,下列说法正确的是
A. 自然界中硅元素以硅酸盐和SiO2形式存在,A不正确;B. 高纯度晶体Si可用于电脑芯片等等,制造光导纤维用的是二氧化硅,B不正确;C. 此反应的发生不能说明该反应条件下C的还原性比Si强,因为该反应是一个熵增的反应,CO气体的生成对反应的发生起着重要作用,CO从反应体系中分离出来有利于化学平衡向正反应方向移动(与工业上用钠置换钾类似),所以C不正确;D. 该反应中电子转移的数目是4e-,标准状况下4.48 L CO的物质的量为0.2mol,所以转移电子数为0.4×6.02×1023,D正确,本题选D。


科目:高中化学 来源: 题型:
【题目】物质的性质决定物质反应的现象,关于钠与水反应的现象和钠的下列性质无关的是( )
A. 钠的熔点较低 B. 钠的密度小于水
C. 钠的硬度较小 D. 钠的还原性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油气“芳构化”是由石油气生产高辛烷值汽油的一种有效生产工艺。测得反应2C4H10![]() C8H10(g)+5H2在不同温度下的平衡常数变化如下:
C8H10(g)+5H2在不同温度下的平衡常数变化如下:
温度(℃) | 400 | 450 | 500 |
平衡常数K | a | 6a | 40a |
(1)该反应的正反应是________(填“吸热”或“放热”)反应。
(2)向2 L密闭定容容器中充入2 mol C4H10,反应10 s后测得H2浓度为1 mol·L-1,此10 s内,以C8H10表示的平均速率为____________________。
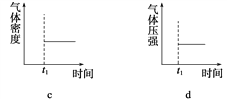
(3)能表示该反应在恒温恒容密闭容器中t1时刻后已经达平衡状态的图示是__________。

(4)下图表示某温度时将一定量的C4H10(含少量H2)充入容器中反应期间物质浓度随时间的变化(容器容积可变),实线代表C8H10,虚线代表C4H10。请用实线补充画出t1~t4间C8H10的浓度变化曲线。_____________
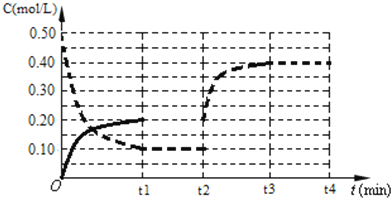
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学方程式中,能够用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
A. BaCl2+K2SO4=BaSO4↓+2KCI
B. BaCO3+H2SO4=BaSO4↓+CO2↑+H2O
C. Ba(OH)2+H2SO4=BaSO4↓+2H2O
D. Ba(OH)2+2KHSO4=BaSO4↓+K2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产过程中处处体现化学变化的无穷魅力,请用化学方程式说明下列变化.
(1)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:向废液中投入过量铁屑,充分反应后分离出固体和滤液;向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.FeCl3蚀刻铜箔反应的离子方程式为 , 鼓入空气时的化学方程式为 .
(2)铝土矿(主要成分是Al2O3)在提炼时首先用NaOH溶液溶解,其离子方程式为 .
(3)工业上制得 NO的化学方程式 . 氮氧化物(NO和NO2)污染环境,若用Na2CO3溶液吸收NO和NO2(两种气体体积之比1:1),可生成CO2和一种盐.则反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如右图所示,下列判断正确的是

A. 50min时,pH=2和pH=7时R的降解百分率相等
B. 溶液酸性越强,R的降解速率越小
C. R的起始浓度越小,降解速率越大
D. 在20~25 min之间,pH=10时R的平均降解速率为0.04mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产以NH3和CO2为原料合成尿素,反应的化学方程式为:
2NH3 (g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)。T1℃时,在2L的密闭容器中充入NH3和CO2模拟工业生产。
CO(NH2)2(l)+H2O(l)。T1℃时,在2L的密闭容器中充入NH3和CO2模拟工业生产。
(1)在密闭容器中充入NH3和CO2,一定条件能自发进行的原因是___________;
(2)若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() ,如右图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________;
,如右图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________;

(3)当x = 2,上述反应至5min时各物质的浓度不再发生变化,若起始的压强为P0KPa,测得平衡体系压强为起始时的2/3。反应结束后,分离得到90g尿素。
①试计算该反应的平均速率v (CO2)=_______________;
②该反应的平衡常数K =_________;
③达到平衡后NH3 的物质的量浓度为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com