
【题目】以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:
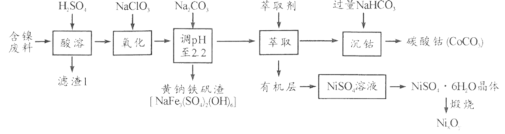
(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________;“滤渣Ⅰ”主要成分为____________________(填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________,为证明添加NaClO3已足量,可用_______________(写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________。
(4)“沉钴”过程的离子方程式________________________。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________。
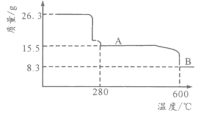
【答案】提高浸出率或提高浸出速率(或其他合理答案) SiO2 Fe2+氧化为Fe3+ K3[Fe(CN)6] 3Fe3++Na++2SO42-+3H2O+3CO32-=NaFe3(SO4)3(OH)6↓+3CO2↑ Co2++2HCO3-=CoCO3↓+CO2↑+H2O 7.3 降温结晶(或冷却结晶) Ni2O3
【解析】
金属镍废料(除含 NiO 外,还含有少量 FeO、Fe2O3、CoO等)加入硫酸酸浸,酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Co2+等,加入NaClO3氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得黄钠铁矾渣,滤液中加入萃取剂得到沉钴和有机层,沉钴中加入NaHCO3溶液得碳酸钴;有机层处理后生成NiSO4溶液,蒸发浓缩、冷却结晶、得NiSO4·6H2O晶体,灼烧得NixOy
(1)“酸溶”时需将含镍废料粉碎,目的是提高浸出率或提高浸出速率(或其他合理答案);
“滤渣Ⅰ”主要成分为SiO2(填化学式)。
(2)"氧化"中添加NaClO3的作用是将Fe2+氧化为Fe3+便于除去,为证明添加NaClO3已足量,实际是检验是否含有Fe2+,可用K3[Fe(CN)6]溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为3Fe3++Na++2SO42-+3H2O+3CO32-=NaFe3(SO4)3(OH)6↓+3CO2↑。
(4)“沉钴”过程的离子方程式Co2++2HCO3-=CoCO3↓+CO2↑+H2O。
若“沉钴”开始时c(Co2+)=0.10 mol/L,Ksp[Co(OH)2]=4.0×10-15=c(Co2+)c2(OH-)=0.10×c2(OH-),c(OH-)=2×10-7,c(H+)=![]() ,pH=-lg
,pH=-lg![]() =7+lg2=7.3,则控制pH≤7.3时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3);
=7+lg2=7.3,则控制pH≤7.3时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3);
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,降温结晶(或冷却结晶),过滤,洗涤,干燥。
“煅烧”时剩余固体质量与温度变化曲线如图,从26.3gNiSO4·6H2O失水变成15.5g,n(NiSO4·6H2O):n(H2O)=![]() ,26.3gNiSO4·6H2O中n(Ni)=
,26.3gNiSO4·6H2O中n(Ni)=![]() =0.10mol,8.3g中n(Ni):n(O)=0.1mol:
=0.10mol,8.3g中n(Ni):n(O)=0.1mol:![]() =2:3,该曲线中B段所表示氧化物的化学式为Ni2O3。
=2:3,该曲线中B段所表示氧化物的化学式为Ni2O3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图为相关物质间的转化关系,其中甲、丙为生活中常见的金属单质,乙、丁为非金属单质且丁为气态,E为白色沉淀,D为浅绿色溶液。请回答:

(1)组成甲的元素在元素周期表中的位置为____________,请列举乙单质的一种用途__________,用电子式表示丁的形成过程________________________
(2)在C溶液中滴入2滴酚酞,再逐滴加入稀盐酸至红色消失,可得到一种胶体,该胶体的胶粒成分是________________(化学式)
(3)反应①的离子方程式为____________________________
(4)将B的稀溶液加水稀释,在图中画出溶液的pH随加水体积的变化趋势曲线。__________

(5)将等物质的量的A和NaOH混合溶于水,该溶液中离子的物质的量浓度由大到小的顺序为:________________________
(6)若反应②中盐酸过量,向D溶液中滴加84消毒液,溶液的颜色发生了变化,该反应的离子方程式为________________________________________,小辉同学欲设计实验,验证D溶液中的阳离子尚未完全被氧化,请你将实验过程补充完整:取反应液少许于试管中,滴加______________________,则证明D中的阳离子未完全被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列常见古诗文对应化学知识正确的是![]()
选项 | 古诗文 | 化学知识 |
A |
| 冰能量低于水,冰变为水属于吸热反应 |
B |
| “强水”是指氢氟酸 |
C |
| 剂钢为铁的合金,其硬度比纯铁的大,熔点比纯铁的高 |
D |
| 鉴别硝石和朴硝利用了焰色反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验探究元素周期律和化学反应速率。
(1)甲组同学欲用下图装置探究同周期和同主族元素非金属性的强弱。
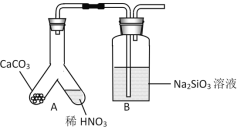
①A中反应现象为____,验证碳的非金属性比氮的___(填“强”或“弱”)。
②B中反应现象为____,验证碳的非金属性比硅的___(填“强”或“弱”)。
③结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”); 同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
④某同学考虑到稀硝酸的挥发,在装置A和B之间增加一个盛有_______试剂的洗气瓶。
(2)乙组同学在恒容容器中进行了三个实验,反应为:2HI(g)H2(g)+I2(g),H2和I2的起始浓度均为0,反应物HI的浓度随反应时间的变化情况如下表:
实验序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
①实验1中,在10~20 min内,v(HI)=__________molL-1min-l。
②0~20 min内,实验2比实验1的反应速率______(填“快”或“慢”),其原因可能是_______________。
③实验3比实验2的反应达到平衡时间_________(填“长”或“短”),其原因是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
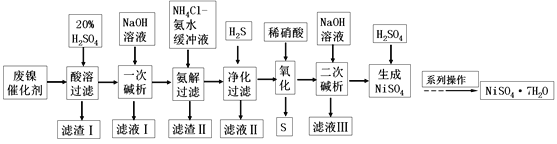
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为了提高浸取率,可采取的措施有________(任写出一条)。
(2)“滤渣I”的主要成分是_________。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为__________。
(4)“氨解”的目的为___,“净化”时加入的H2S的目的是将镍元素转化为____沉淀。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于_______(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为________,离子交换膜(b)为__________(填“阴”或“阳”)离子交换膜。
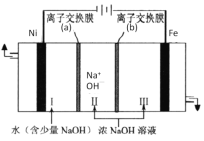
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行相关实验。下列结论正确的是
A.向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+c(CO32-)
B.向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-)
C.向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13
D.将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3
C.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
D.加入催化剂有利于氨的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置可用于模拟呼吸面具中人呼出的气体与过氧化钠反应产生氧气的过程。看图并回答下列问题:
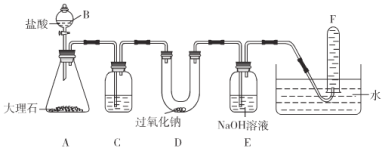
(1)仪器B的名称是____________,C中盛放饱和![]() 溶液,其作用是____________。
溶液,其作用是____________。
(2)写出D中![]() 与
与![]() 反应的化学方程式______________________________________。
反应的化学方程式______________________________________。
(3)检验F中所收集到气体的方法是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___种;基态铜原子的价电子排布式为___。
(2)N和O中第一电离能较小的元素是__;SO42-的空间构型___。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为___,H2O2难溶于CC14,其原因为___。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___。
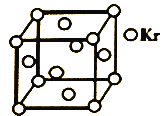
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏加德罗常数的值,晶胞边长为540pm,则该晶体的密__g/cm3(只列式不计算,Kr摩尔质量为84g·mol-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com