
【题目】空气质量评价的主要污染物为PM 10、PM2.5、SO2、NO2、O3、CO等物质。烟气的脱硝(除NOx)
技术和脱硫(除SO2)技术都是环境科学研究的热点,选择性催化还原法(SCR)是目前最成熟的烟气脱硝技术,即在催化剂的作用下,用还原剂选择性地与NOx反应生成N2和H2O。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____________。
(2)用热炭还原NO的反应为2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 | 200 |
n(NO) /mol(甲容器/T1℃) | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 | 0. 80 |
n(NO) /mol(乙容器/T1℃) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 | 0.40 |
n(NO) /mol(丙容器/T2℃) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 | 1.00 |
①该反应T1_________T2,H________0 (填“<”或“>”)。
②若乙容器在200min达到平衡状态,则0~ 200min内用CO2的浓度变化表示的平均反应速率v(CO2)=____。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2CO2的物质的量浓度与平衡总压的关系如图18所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2CO2的物质的量浓度与平衡总压的关系如图18所示:

①A、B两点的浓度平衡常数关系:Kc(A)__________ (填“<” 、“>” 或“=”)
②A、B、C三点中NO2的转化率最低的是________(填“A” 、“B” 或“C”)点。
③计算C点时该反应的压强平衡常数Kp(c)=___________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)在催化剂的作用下,尿素可以与NO2反应生成N2、H2O和CO2。写出CO(NH2)2与NO2反应的化学方程式:___________。
(5)氮的化合物应用广泛。氯胺(NH2Cl)是常用的饮用水二级消毒剂,可作长效缓释消毒剂,已知NH2Cl易水解生成强氧化性的物质,写出NH2Cl与水反应的化学方程式:_______________。
【答案】 2NO(g)+2H2(g)=N2(g)+2H2O(g) H=665kJ·mol1 < < 0.0015mol·L1·min1 = B 2Mpa 4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O(或4CO(NH2)2+6NO2
7N2+4CO2+8H2O(或4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O) NH2Cl+H2O
7N2+4CO2+8H2O) NH2Cl+H2O![]() NH3+HClO(或NH2Cl+2H2O
NH3+HClO(或NH2Cl+2H2O![]() NH3·H2O+HClO)
NH3·H2O+HClO)
【解析】(1)根据题知条件可得:①2NO(g)=2N(g)+2O(g)ΔH=+1260 kJ·mol-1②2N(g)=N2(g)ΔH=-945 kJ·mol-1③2H2(g)= 4H(g)ΔH=+872 kJ·mol-1④4H(g)+2O(g)= 2H2O(g)ΔH=-1852 kJ·mol-1根据盖斯定律,①+②+③+④得:2NO(g)+2H2(g)=N2(g)+2H2O(g)H=665kJ·mol1 答案为:2NO(g)+2H2(g)=N2(g)+2H2O(g) H=665kJ·mol1
(2)①根据表中信息,可比较初始投料量相同的甲、丙容器,可观察得反应速率:甲<丙,说明温度T1<T2;而平衡时n(NO):甲<丙,说明由甲至丙温度升高,平衡逆向移动,故该反应为放热反应,H<0;答案为:<,<
②参与反应的n(NO)=1mol-0.4mol=0.6mol,生成的n(CO2)=0.3mol,v(CO2)= 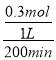 =0.0015mol·L1·min1 ,答案为: 0.0015mol·L1·min1
=0.0015mol·L1·min1 ,答案为: 0.0015mol·L1·min1
(3)①平衡常数只受温度的影响,恒温条件下平衡常数保持恒定,故Kc(A)=Kc(B);②该反应为正向气体体积增大的反应,则在压强较高时有利于反应逆向进行,结合图中信息可知,B点压强较高,对应平衡时c(NO2)也较高,故B点转化率最低;
③起始时二氧化氮为1mol,C点时,二氧化氮和二氧化碳的物质的量浓度相等,可知此反应体系中n(NO2)=0.5mol,n(N2)=0.25mol,n(CO2)=0.5mol,各物质浓度关系为:c(NO2):c(CO2):c(N2)=2:2:1,则三种气体平衡分压为![]() ,
,![]() ,
,![]() ,则
,则![]() ;答案为:= , B , 2Mpa
;答案为:= , B , 2Mpa
(4)尿素与NO2反应生成N2、H2O和CO2,所以CO(NH2)2与NO2反应的化学方程式为:4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O(或4CO(NH2)2+6NO2
7N2+4CO2+8H2O(或4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O),答案为:4CO(NH2)2+6NO2
7N2+4CO2+8H2O),答案为:4CO(NH2)2+6NO2![]() 7N2+4CO2+8H2O(或4CO(NH2)
7N2+4CO2+8H2O(或4CO(NH2)![]() 7N2+4CO2+8H2O)
7N2+4CO2+8H2O)
(5)NH2Cl水解生成一水合氨和次氯酸,NH2Cl+2H2O![]() NH3·H2O+HClO或NH2Cl+H2O
NH3·H2O+HClO或NH2Cl+H2O![]() NH3+HClO,答案为:NH2Cl+H2O
NH3+HClO,答案为:NH2Cl+H2O![]() NH3+HClO(或NH2Cl+2H2O
NH3+HClO(或NH2Cl+2H2O![]() NH3·H2O+HClO)
NH3·H2O+HClO)


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L NO和11.2LO2混合后气体的分子总数为NA
B. 1L1mol·L-1的Na2CO3溶液中含有的阴离子数目大于NA
C. 100mL 12mol·L-1浓盐酸与足量的MnO2共热,转移的电子数为0.6NA
D. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的Cu和1 mol·L-1的稀硝酸反应,如果NO的浓度下降0.2 mol·L-1,则溶液中c(H+)同时下降(假定反应前后溶液体积不变)( )
A.0.2 mol·L-1
B.0.8 mol·L-1
C.0.6 mol·L-1
D.0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名科学家张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量的新值为152。则下列说法正确的是( )
A.铕元素的原子质子数为63B.铕元素的原子中子数为63
C.铕元素的原子核外电子数为152D.铕元素的原子的质量为152
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯 (环上氢原子未标出,每个折点表示一个碳原子),具有抗菌作用.若1mol七叶树内酯分别跟浓溴水和NaOH溶液完全反应,则消耗的溴和NaOH的物质的量分别为( ) 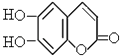
A.3mol,2mol
B.3mol,4mol
C.2mol,3mol
D.4mol,4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2mol有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.
(1)通过计算推断该有机物的化学式.
(2)若0.2mol该有机物恰好与4.6g金属钠完全反应,试确定该有机物的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,已知:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH1
4Al(s)+3O2(g)=2Al2O3(s) ΔH2
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是
A. ΔH3=1/2(ΔH1+ΔH2) B. ΔH3=ΔH2-ΔH1
C. ΔH3=2(ΔH2+ΔH1) D. ΔH3=1/2 (ΔH2-ΔH1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com