
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L NO和11.2LO2混合后气体的分子总数为NA
B. 1L1mol·L-1的Na2CO3溶液中含有的阴离子数目大于NA
C. 100mL 12mol·L-1浓盐酸与足量的MnO2共热,转移的电子数为0.6NA
D. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
【答案】B
【解析】A.标准状况下,22.4L NO和11.2LO2混合,混合后气体发生反应:2NO+O2=2NO2,得到1mol的NO2,但是又存在2NO2![]() N2O4,所以混合后气体的分子总数小于1NA,A错误;B.1L1mol·L-1的Na2CO3溶液中含有溶质碳酸钠1mol,由于碳酸根离子部分水解,且碳酸根的水解会导致阴离子个数增多,故溶液中的阴离子的个数多于1NA,B正确;C.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故盐酸不能反应完全,则转移的电子数小于0.6NA个,C错误.D.1个白磷分子中含有6个P-P键,1个甲烷分子中含有4个C-H键,所以共价键数均为0.4NA的白磷(P4)和甲烷的物质的量不可能相等,D错误;答案选B.
N2O4,所以混合后气体的分子总数小于1NA,A错误;B.1L1mol·L-1的Na2CO3溶液中含有溶质碳酸钠1mol,由于碳酸根离子部分水解,且碳酸根的水解会导致阴离子个数增多,故溶液中的阴离子的个数多于1NA,B正确;C.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故盐酸不能反应完全,则转移的电子数小于0.6NA个,C错误.D.1个白磷分子中含有6个P-P键,1个甲烷分子中含有4个C-H键,所以共价键数均为0.4NA的白磷(P4)和甲烷的物质的量不可能相等,D错误;答案选B.


科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M,常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。M属于芳香族化合物,苯环上只含有一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162g·mol-1,只含碳、氢、氧,且原子个数之比为5:5:1。
(1)肉桂酸甲酯的结构简式是______________________。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。G的结构简式为_________________。

(3)用芳香烃A为原料合成G的路线如下:

①化合物E中的官能团有________(填名称)。
②E→F的反应类型是________,
F→G的化学方程式为__________________________________________________。
③写出两种符合下列条件的F的稳定的同分异构体的结构简式_________________。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,最多消耗5mol H2;
ⅲ.它不能发生水解反应,但可以发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )
A.9:1
B.1:11
C.1:9
D.11:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气)![]() 2C(气)若达到平衡的标志是
2C(气)若达到平衡的标志是
A. C的生成速率与B的生成速率相等
B. A、B、C的浓度不再发生变化
C. 单位时间内生成nmolA,同时生成3nmolB
D. A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为________。写出SOCl2吸收水蒸气的化学方程式:____________。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):

①装置的连接顺序为A→B→______→______→______→______。
②搅拌的作用是______,冷凝管的作用是______。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg。若![]() _____(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
_____(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热即可得到无水ZnCl2,但老师说此方法不可。请用化学方程式解释原因:____________。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。请你设计并简述实验方案判断丁同学的观点:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( ) 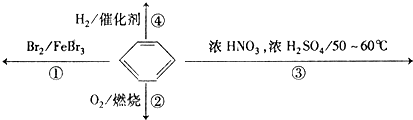
A.反应①为取代反应,有机产物与水混合浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C.反应③为取代反应,有机产物是一种烃
D.反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
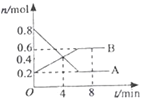
(1)该反应的化学方程式为________________;
(2)若降低温度,则v (正)_____,v (逆)_____;(填“加快”“减慢”或“不变”);
(3)第4min时,正、逆反应速率的大小关系为:v (正)______ v (逆);(填“>”“<”或“=”,下同)
(4)以下措施能加快反应速率的是_________。
A.恒温恒容充入He使压强增大 B.缩小体积,使压强增大
C.恒温恒压充入He D.平衡后加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量评价的主要污染物为PM 10、PM2.5、SO2、NO2、O3、CO等物质。烟气的脱硝(除NOx)
技术和脱硫(除SO2)技术都是环境科学研究的热点,选择性催化还原法(SCR)是目前最成熟的烟气脱硝技术,即在催化剂的作用下,用还原剂选择性地与NOx反应生成N2和H2O。
(1)在催化剂存在的条件下,用H2将NO还原为N2。已知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_____________。
(2)用热炭还原NO的反应为2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为T1℃、T1℃、T2℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 | 200 |
n(NO) /mol(甲容器/T1℃) | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 | 0. 80 |
n(NO) /mol(乙容器/T1℃) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 | 0.40 |
n(NO) /mol(丙容器/T2℃) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 | 1.00 |
①该反应T1_________T2,H________0 (填“<”或“>”)。
②若乙容器在200min达到平衡状态,则0~ 200min内用CO2的浓度变化表示的平均反应速率v(CO2)=____。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2CO2的物质的量浓度与平衡总压的关系如图18所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量C发生该反应,测得平衡时NO2CO2的物质的量浓度与平衡总压的关系如图18所示:

①A、B两点的浓度平衡常数关系:Kc(A)__________ (填“<” 、“>” 或“=”)
②A、B、C三点中NO2的转化率最低的是________(填“A” 、“B” 或“C”)点。
③计算C点时该反应的压强平衡常数Kp(c)=___________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)在催化剂的作用下,尿素可以与NO2反应生成N2、H2O和CO2。写出CO(NH2)2与NO2反应的化学方程式:___________。
(5)氮的化合物应用广泛。氯胺(NH2Cl)是常用的饮用水二级消毒剂,可作长效缓释消毒剂,已知NH2Cl易水解生成强氧化性的物质,写出NH2Cl与水反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 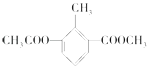 ,关于该物质的叙述错误的是( )
,关于该物质的叙述错误的是( )
A.一分子该物质中含有12个H原子
B.该物质的一氯代物有4种
C.该物质能使酸性KMnO4溶液褪色
D.1 mol该物质分别与足量H2、NaOH溶液反应,消耗H2、NaOH的物质的量均为3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com