
【题目】在一定温度下,等容密闭容器中进行可逆反应:A(g)+2B(s)![]() 3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
A.A、B、C的分子数目比为1:2:3B.容器内压强不再变化
C.单位时间生成lmolA,同时消耗2molBD.C的生成速率与C的分解速率相等
【答案】A
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A.物质A、B、C的分子数之比为1:3:2,并不是不变的状态,故A错误;
B.反应前后气体的压强不同,当容器内压强不再变化,可以说明反应达到平衡状态,故B正确;
C.单位时间生成lmolA,也生成2mol的B,同时消耗2molB,B的生成速率与消耗速率相等,能说明反应达到平衡状态,故C正确
D.C的生成速率与C的分解速率相等,正逆反应速率相等,反应达到平衡状态,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。字母代表元素,分析正确的是
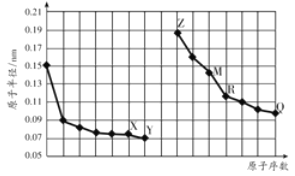
A. R在周期表的第15列
B. Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
C. 简单离子的半径:X>Z>M
D. Z的单质能从M与Q元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式:
①![]() ; ②
; ②![]() ;
;
③![]() ; ④
; ④![]() 。
。
则下列有关比较中正确的是
A. 电负性:④>③>②>① B. 原子半径:④>③>②>①
C. 第一电离能:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A. B.
B.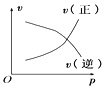 C.
C.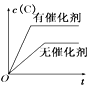 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO47H2O。
(4)硫酸亚铁铵[(NH4)2SO4FeSO46H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成是一个需要经历多步反应的过程,我们常用的塑料包装绳(主要成分为聚氯乙烯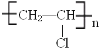 就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出__________________________________
就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
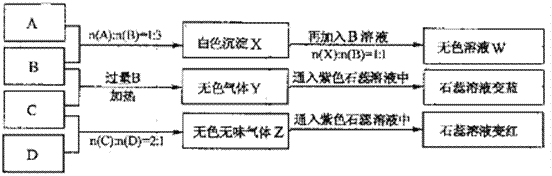
请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为_______、_______。
(2)D溶液pH__(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)__________。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是________________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为元素周期表中前20号元素,其原子序数依次增大。其中
为元素周期表中前20号元素,其原子序数依次增大。其中![]() 、
、![]() 是金属元素;
是金属元素;![]() 和
和![]() 同主族,它们原子的最外层电子排布式均为
同主族,它们原子的最外层电子排布式均为![]() ;
;![]() 和
和![]() 同主族,它们原子最外层的
同主族,它们原子最外层的![]() 能级电子数是
能级电子数是![]() 能级电子数的2倍;
能级电子数的2倍;![]() 元素原子最外层电子数是
元素原子最外层电子数是![]() 元素原子最外层电子数的
元素原子最外层电子数的![]() 。已知五种元素的电负性为2.5、3.5、0.8、2.1、1.5,请回答下列问题:
。已知五种元素的电负性为2.5、3.5、0.8、2.1、1.5,请回答下列问题:
(1)![]() 是______(填元素符号,下同),
是______(填元素符号,下同),![]() 是______,
是______,![]() 是______,
是______,![]() 是______,
是______,![]() 是______。
是______。
(2)五种元素中金属性最强的是______(填元素符号,下同),非金属性最强的是______。
(3)当![]() 与
与![]() 、
、![]() 、
、![]() 分别形成化合物时,
分别形成化合物时,![]() 显______(填“正”或“负”,下同)价,其他元素显______价。
显______(填“正”或“负”,下同)价,其他元素显______价。
(4)当![]() 与
与![]() 、
、![]() 、
、![]() 、
、![]() 分别形成简单化合物(其中
分别形成简单化合物(其中![]() 、
、![]() 、
、![]() 、
、![]() 均显最高价,
均显最高价,![]() 显最低负价)时,化合物中含有离子键的是______(填化学式,下同),含有共价键的是______。
显最低负价)时,化合物中含有离子键的是______(填化学式,下同),含有共价键的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com