
【题目】现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
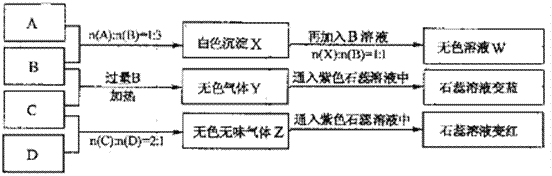
请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为_______、_______。
(2)D溶液pH__(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)__________。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是________________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是______________________________________________________________
【答案】Al2O3 NaAlO2 大于 CO32-+H2O![]() HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-)
HCO3-+OH- NaOH>Na2CO3>AlCl3>NH4HSO4 > c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-)
【解析】
由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D就为Na2CO3气体,Z为CO2,
(1)加热促进盐类的水解,根据盐类水解原理分析;
(2) 强碱弱酸盐,水解显碱性;
(3)根据酸、碱的电离以及盐类的水解的角度比较溶液pH的大小;
(4)从盐类水解的影响因素以及平衡移动的角度分析;
(5)从溶液电荷守恒的角度分析。
由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D就为Na2CO3气体Z为CO2;
(1)A是AlCl3,AlCl3水解:Al3++3H2OAl(OH)3+3H+,升高温度,氯化氢挥发,平衡右移,灼烧氢氧化铝,分解为氧化铝;W是NaAlO2,水解:AlO2-+2H2O Al(OH)3+OH-,升温后,平衡左移,因为氢氧根离子的存在,不存在Al(OH)3,溶液蒸干后得到NaAlO2固体;
故答案为Al2O3、NaAlO2;
(2)碳酸钠属于强碱弱酸盐,水解显碱性,离子方程式为:CO32-+H2O![]() HCO3-+OH-,溶液pH大于7;
HCO3-+OH-,溶液pH大于7;
故答案为大于;CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(3)其中NaOH和Na2CO3呈碱性的pH大于7,而且NaOH碱性> Na2CO3, AlCl3和NH4HSO4呈酸性, pH小于7,NH4HSO4酸性> AlCl3,所以等物质的量浓度A、B、C、D的pH由大到小的顺序是NaOH>Na2CO3>AlCl3>NH4HSO4;
答案是: NaOH>Na2CO3>AlCl3>NH4HSO4;
(4)等物质的量浓度的NH4HSO4与NH4Cl溶液, NH4HSO4电离出的H+对NH4+的水解起到抑制作用,所以c(NH4+)前者>后者;
答案是: >;
(5)B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中存在硫酸钠、硫酸铵以及氨水等溶质,混合溶液呈中性,则c(H+)=c(OH-),由电荷守恒有c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-);
答案是: c(Na+)>c(SO42-)> c(NH4+)>c(H+) =c(OH-).


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碳碳单键、碳碳双键、碳碳三键均能绕键轴旋转
B.烷烃分子中一个碳原子形成的四个键中每两个键的夹角均为109°28
C.甲烷、乙烯、乙炔分子中碳原子均为![]() 杂化
杂化
D.乙炔分子中碳碳三键与碳氢键的夹角为180°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,等容密闭容器中进行可逆反应:A(g)+2B(s)![]() 3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
A.A、B、C的分子数目比为1:2:3B.容器内压强不再变化
C.单位时间生成lmolA,同时消耗2molBD.C的生成速率与C的分解速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是 ( )
A.在稀氨水中加水稀释,![]() 会增大
会增大
B.若酸性HA>HB,则等物质的量浓度等体积的NaA和NaB溶液混合有关系: c(OH-)>c(A-)>c(B-)>c(H+)
C.0.1 mol·L-1的一组溶液pH由大到小排列为: NaOH>Na2CO3>NaHSO4>(NH4)2SO4
D.分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
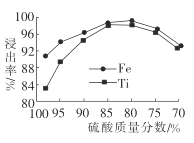
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的相对原子质量为34.969,下列相关说法正确的是( )
的相对原子质量为34.969,下列相关说法正确的是( )
A.氯元素的近似相对原子质量为35
B.氯元素的某种同位素的质量数为35
C.氯元素的中子数为18
D.氯原子的质量为34.969
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为 136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
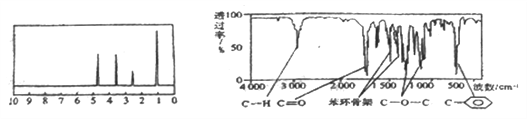
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。请回答以下问题:

(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,其中Be(OH)2显示这种性质的离子方程式是 __________________________、_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com