
| A、铁跟硫酸铜溶液反应:2Fe+3Cu2+=2Fe3++3Cu |
| B、饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C、在碳酸氢钙溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |
| D、在澄清石灰水里通入过量二氧化碳:OH-+CO2=HCO3- |


科目:高中化学 来源: 题型:
 的名称是
的名称是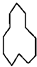 名称是
名称是 其名称是
其名称是查看答案和解析>>
科目:高中化学 来源: 题型:
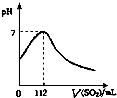 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )| A、0.5 mol?L─1 |
| B、0.05 mol?L─1 |
| C、1 mol?L─1 |
| D、0.1 mol?L─1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| B、向次氯酸钙溶液中通入过量二氧化硫Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、向硫酸氢钠溶液中滴入氢氧化钡溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、将氢氧化铁粉末加入氢碘酸:Fe(OH)3+3H=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、AlCl3 溶液中投入过量Na:Al3++4Na+2H2O=AlO2-+4Na++2H2↑ |
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| D、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色和状态 | 密度/g?cm3 | 0℃时溶解度/g | 100℃时溶解度/g |
| KCl | 无色晶体 | 1.98 | 27.6 | 56.7 |
| KClO3 | 无色晶体 | 2.32 | 3.3 | 57 |
| KClO4 | 无色晶体 | 2.32 | 0.75 | 21.8 |
| 1 |
| 3 |
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 4 |
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 | MnSO4固体 | 0.10mol/LKMnO4溶液 | 褪色时间 |
| 1 | 65℃ | - | - | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | - | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | - | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:
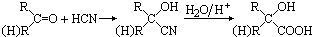 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成: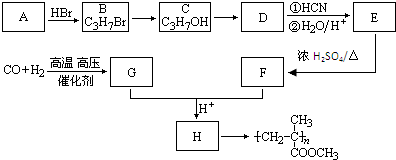
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com