
| 物质 | 颜色和状态 | 密度/g?cm3 | 0℃时溶解度/g | 100℃时溶解度/g |
| KCl | 无色晶体 | 1.98 | 27.6 | 56.7 |
| KClO3 | 无色晶体 | 2.32 | 3.3 | 57 |
| KClO4 | 无色晶体 | 2.32 | 0.75 | 21.8 |
| 1 |
| 3 |
| 1 |
| 10 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| A、2.4×10-7mol?L-1 | ||
| B、0.14×10-7mol?L-1 | ||
C、
| ||
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3:6 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁跟硫酸铜溶液反应:2Fe+3Cu2+=2Fe3++3Cu |
| B、饱和石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C、在碳酸氢钙溶液中加入盐酸:CO32-+2H+=CO2↑+H2O |
| D、在澄清石灰水里通入过量二氧化碳:OH-+CO2=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O |
| B、FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、NaNO2溶液加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
| D、Fe(NO3)3溶液加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
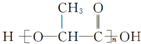 ,有关W的信息如图,据此回答下列问题:
,有关W的信息如图,据此回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ; ②
; ② ,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构.试根据图中各有机物的相互转化关系回答:
,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构.试根据图中各有机物的相互转化关系回答:
查看答案和解析>>
科目:高中化学 来源: 题型:
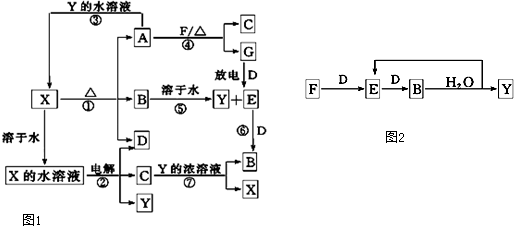
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com