
| A、已知有2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为NA个 |
| B、电解精炼镍时,当电源提供NA个电子时,阳极溶解的Ni2+应为0.5mol |
| C、标准状况下,22.4L SO2和O2的混合气体中含有的氧原子数为2NA |
| D、向足量MnO2中加入溶有4mol HCl的浓盐酸,加热,反应后的溶液中的Cl-数是2NA个(不考虑盐酸的挥发) |
| V |
| 22.4 |
| V |
| 22.4 |
| 22.4L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、使甲基橙变红色的溶液:Mg 2+、K+、SO4 2-、NO3- |
| B、PH=13的溶液:Na+、Cu 2+、HCO3-、NO3- |
| C、水电离出的c(H+)=10-12 mol/L的溶液:K+、Na+、CO3 2-、Br- |
| D、0.1mol/L的AgNO3的溶液:H+、K+、SO4 2-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | C-O | C O | H-O |
| 能量/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
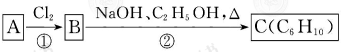
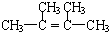 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.045mol?L-1 |
| B、0.036mol?L-1 |
| C、0.026mol?L-1 |
| D、0.030mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、Ca(HCO3)2溶液中加入足量NaOH溶液:HCO3-+OH-=H2O+CO32- |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
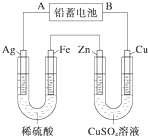 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
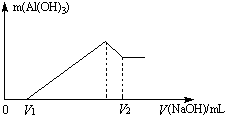 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com