
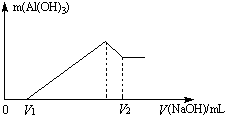
 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:| n |
| c |
| n |
| c |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.4mol |
| 2mol/L |
| 1.2mol |
| 2mol/L |


科目:高中化学 来源: 题型:
| A、已知有2mol Na218O2与足量的CO2充分反应,生成的碳酸钠中含18O的原子为NA个 |
| B、电解精炼镍时,当电源提供NA个电子时,阳极溶解的Ni2+应为0.5mol |
| C、标准状况下,22.4L SO2和O2的混合气体中含有的氧原子数为2NA |
| D、向足量MnO2中加入溶有4mol HCl的浓盐酸,加热,反应后的溶液中的Cl-数是2NA个(不考虑盐酸的挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
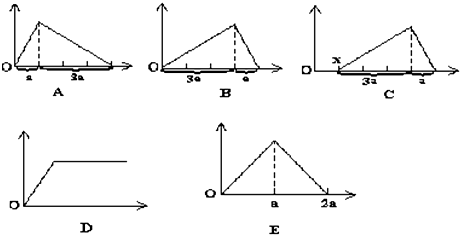
科目:高中化学 来源: 题型:
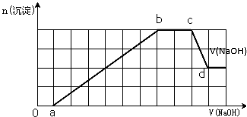
| A、原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| B、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ |
| C、原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种 |
| D、d点溶液中含有的溶质只有Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、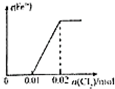 |
B、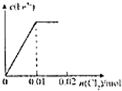 |
C、 |
D、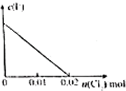 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.
龙胆酸甲酯是制取抗心律失常药物--氟卡尼的中间体.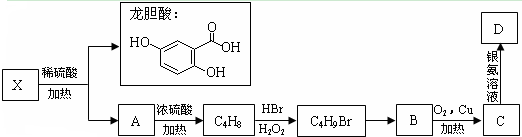
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com