
| 40g×20% | ||
|
| 28.1g |
| 74.5 |
| 56.78g |
| 119g/mol |
| 250g |
| 1.01×103g/L |
| n |
| V |
| 1 |
| 2 |
| 40g×20% | ||
|
| 28.1g |
| 74.5 |
| 56.78g |
| 119g/mol |
| 250g |
| 1.01×103g/L |
| n |
| V |
| 0.477mol |
| 0.2475L |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | C-O | C O | H-O |
| 能量/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
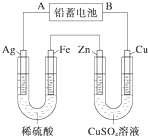 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
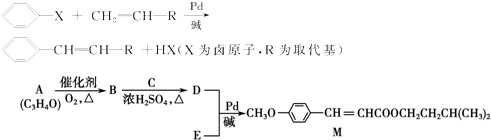
查看答案和解析>>
科目:高中化学 来源: 题型:
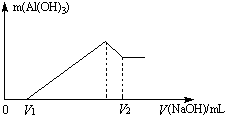 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
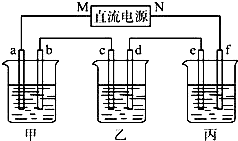 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com