
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
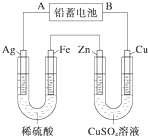 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
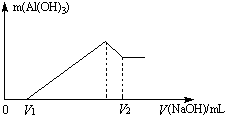 将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.8g溶于100mL 6mol/L的H2SO4溶液中,然后再滴加2mol/L的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 使用100mL的量筒量取一定体积的液体 | 准确量取9.4mL盐酸 |
| B | 用石墨做电极电解等物质的量浓度的NaX和NaY的混合溶液 | 比较X-、Y-的还原性强弱 |
| C | 往浸过火柴头(一般是KClO3、MnO2、S等)的溶液中加AgNO3溶液和稀硝酸 | 检验火柴头中含氯元素 |
| D | 将NH4Cl固体加热分解 | 制取HCl和NH3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、工、石油等工业生产上,300~400℃左右分解.| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
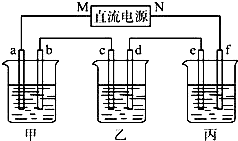 如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.
如图所示装置中,甲乙丙三个烧杯依次分别盛放KCl溶液,CuSO4溶液、K2SO4溶液的混合液,AgNO3溶液,a、b、c、d均为石墨电极,e为铜极,f为银极,若电解5min时,测得铜极的质量增加了2.16g.查看答案和解析>>
科目:高中化学 来源: 题型:
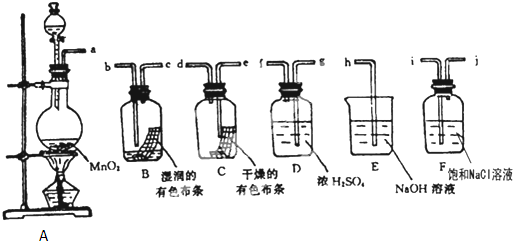
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com