
【题目】![]() 时,向
时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() ,反应
,反应![]() 经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是![]()
![]()

A.反应在前50s的平均速率![]()
![]()
B.相同温度下,起始时向容器中充入![]() mol
mol![]() 和
和![]() mol
mol![]() ,达到平衡时,
,达到平衡时,![]() 的转化率小于
的转化率小于![]()
C.![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]()
D.相同温度下,起始时向容器中充入![]() mol
mol![]() 、
、![]() mol
mol![]() 和
和![]() mol
mol![]() ,反应达到平衡前
,反应达到平衡前![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:

(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铃兰醛[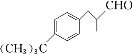 ]具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰等东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如图所示:
]具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰等东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如图所示:
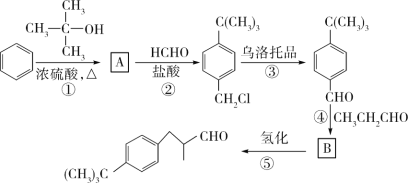
(1)B中官能团的名称是______。
(2)①的反应类型是______。
(3)写出反应②的化学方程式:______。
(4)乌洛托品的结构简式如图所示:
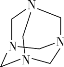
其二氯取代物有______种,将甲醛的水溶液与氨水混合蒸发可制得乌洛托品,该反应的化学方程式是______。
(5)写出满足下列条件的A的同分异构体______。
Ⅰ.有两个取代基 Ⅱ.取代基在邻位
(6)已知:RCH2COOH![]() RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸
RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸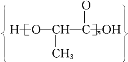 的合成路线______(无机试剂自选)。
的合成路线______(无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()

A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.计算下列溶液的pH值(25 ℃),(请写出计算过程)将20mL0.01 mol·L-1 KOH溶液与30mL0.005mol·L-1H2SO4溶液混合并加水至100ml.
(1)求KOH溶液的pH值_______________;
(2)求H2SO4溶液的pH值_______________;
(3)求混合液的pH值_______________。
II.将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(酸)与强碱的pH(碱)之间应满足的关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A.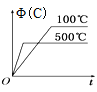 B.
B.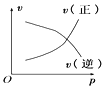 C.
C.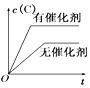 D.
D.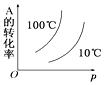
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,请根据实验室和工业上制氢及氢气性质回答相关问题。
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是______________;
(2)要加快上述实验中产生氢气的速率,还可采取的措施有______、_______(列举两种措施)。
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因____________。
II.工业上海水制氢气的新技术:2H2O![]() 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:
(1)分解海水的反应属于_____反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的____极。
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2![]() HCOONa+H2O。下列有关说法正确的是____。
HCOONa+H2O。下列有关说法正确的是____。
A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com