
【题目】在氢氟酸溶液中,存在如下电离平衡:HF![]() H+ + F-
H+ + F-
(1)加入固体NaOH ,电离平衡向________移动, c(H+)_______________。
(2)加入固体NaF , 电离平衡向________移动 , c(H+)____________。
(3)常温下,pH=12的NaOH和pH= 2的HCl等体积混合后,pH= ____________。
【答案】右 减小 左 减小 7
【解析】
(1)减小氢离子浓度,平衡右移;
(2)增加氟离子浓度,平衡左移;
(3)强酸和强碱反应,根据n(H+)和n(OH-)之间关系判断溶液的酸碱性。
在氢氟酸溶液中,存在如下电离平衡:HF![]() H+ + F-:
H+ + F-:
(1)对于电离平衡:HF![]() H+ + F-,加入固体NaOH ,氢氧根离子和氢离子发生反应,减少了氢离子浓度,即c(H+)减小,电离平衡向右移动;综上所述,本题答案是:右;减小。
H+ + F-,加入固体NaOH ,氢氧根离子和氢离子发生反应,减少了氢离子浓度,即c(H+)减小,电离平衡向右移动;综上所述,本题答案是:右;减小。
(2)对于电离平衡:HF![]() H+ + F-,加入固体NaF ,相当于增加了c(F-),电离平衡向左移动,c(H+)减小;综上所述,本题答案是:左; 减小。
H+ + F-,加入固体NaF ,相当于增加了c(F-),电离平衡向左移动,c(H+)减小;综上所述,本题答案是:左; 减小。
(3)常温下,KW=c(H+)c(OH-)=10-14;pH=12的NaOH,c(OH-)=10-2mol/L,pH=2的HCl,c(H+)=10-2mol/L,而二溶液体积相等,所以n(H+)=10-2Vmol,n(OH-)=10-2Vmol,酸碱恰好完全中和,生成氯化钠,为强酸强碱盐,溶液显中性,pH=7;综上所述,本题答案是:7。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解有关的是( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在盐酸中,而后加水稀释
④NH4Cl溶液可作焊接中的除锈剂
⑤实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会生成氢气
⑧草木灰与铵态氮肥不能混合施用
⑨加热蒸干AlCl3溶液得到Al(OH)3固体.
A. ①④⑦ B. ②⑤⑧ C. ③⑥⑨ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于塑料的说法正确的是( )
A.塑料是天然高分子材料
B.聚乙烯塑料薄膜是以CH2=CHCl为原料通过加聚反应而制得的
C.塑料都具有热塑性
D.塑料的主要成分是合成树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是
A. 两种溶液等体积混合后,溶液呈碱性
B. 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+)
C. 分别稀释10倍,两溶液的pH之和大于14
D. 若两溶液混合后pH=7,则有c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
B. 25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O![]() H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C. 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
D. 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为阴极:产生无色气体;阳极:有白色胶状沉淀生成且逐渐增多;U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
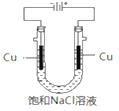
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com