
【题目】甲、乙是同主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. x+2B. x+4C. x+8D. x+18
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】航空和电器行业中使用的垫圈多为橡胶,制作这些垫圈的橡胶必须具备耐高温、耐低温、耐氧化等特点。下列橡胶可用于制作航空和电器行业中的垫圈的是( )
A.天然橡胶B.丁苯橡胶C.氯丁橡胶D.有机硅橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用金属活动性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A. 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
B. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
C. Fe+CuSO4 =FeSO4+Cu
D. 2NaCl(水溶液)![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氢氟酸溶液中,存在如下电离平衡:HF![]() H+ + F-
H+ + F-
(1)加入固体NaOH ,电离平衡向________移动, c(H+)_______________。
(2)加入固体NaF , 电离平衡向________移动 , c(H+)____________。
(3)常温下,pH=12的NaOH和pH= 2的HCl等体积混合后,pH= ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)
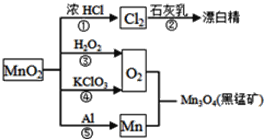
A. 反应⑤说明该条件下铝的还原性强于锰
B. 反应①②③④⑤均属于氧化反应和离子反应
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:
Na2SO3+S+5H2O![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6gNa2SO3于100mL烧杯中,加50mL去离子水搅拌溶解。
②另取4.0g硫粉于200mL烧杯中,加6mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉网小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中,_________________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为__________________________。
(4)滤液中除Na2S2O3 和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00g产品(硫代硫酸钠晶体的摩尔质量为248g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/LI2的标准溶液滴定,反应的离子方程式为:2S2O32-+I2=S4O62-+2I-,记录数据如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.30 | 21.32 |
2 | 0.36 | 22.56 |
3 | 0.10 | 21.08 |
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3 常用于脱氯剂,在溶液中易被Cl2 氧化为SO42-,该反应的离子方程式为 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究![]() 的性质,某同学按如图所示的装置进行实验。
的性质,某同学按如图所示的装置进行实验。

完成下列填空:
(1)装置A中盛放浓碱酸的仪器名称是________________,A中发生反应的化学方程式是___________________。
(2)装置B中的现象是________________________,说明![]() 具有________(填代码);装置C中发生反应的化学方程式是________________________________,说明
具有________(填代码);装置C中发生反应的化学方程式是________________________________,说明![]() 具有________(填代码)。
具有________(填代码)。
a.氧化性 b.还原性 c.漂白性 d.酸性
(3)装置D的目的是探究![]() 与品红作用的可逆性,写出实验操作及现象________________________尾气可采用________溶液吸收。
与品红作用的可逆性,写出实验操作及现象________________________尾气可采用________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:

已知生成氢氧化物沉淀的pH如下表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 3.4 | 6.3 | 1.5 |
完全沉淀 | 4.7 | 8.3 | 2.8 |
回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅱ是_______________、_________________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的方法______________________________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为:__________。
(5)调节pH=3的目的是_______________________ ,滤渣2含有的物质是______。
II.(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+) =_________ (保留三位有效数字)。[已知Ksp(PbS)=3.4×10-28,
Ksp(CuS)=1.3×10-36]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下:![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl 
已知:氯苯为无色液体,沸点132.2 ℃。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是______。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60 ℃为宜,温度过高会生成二氯苯。
①对C加热的方法是________(填字母)。
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、________和________。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:_____________、__________(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是________。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg·t-1) | 13 | 24.9 | 51.3 | 89.2 |
则1 t苯可制得成品为________t(只要求列式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com