
【题目】为探究![]() 的性质,某同学按如图所示的装置进行实验。
的性质,某同学按如图所示的装置进行实验。

完成下列填空:
(1)装置A中盛放浓碱酸的仪器名称是________________,A中发生反应的化学方程式是___________________。
(2)装置B中的现象是________________________,说明![]() 具有________(填代码);装置C中发生反应的化学方程式是________________________________,说明
具有________(填代码);装置C中发生反应的化学方程式是________________________________,说明![]() 具有________(填代码)。
具有________(填代码)。
a.氧化性 b.还原性 c.漂白性 d.酸性
(3)装置D的目的是探究![]() 与品红作用的可逆性,写出实验操作及现象________________________尾气可采用________溶液吸收。
与品红作用的可逆性,写出实验操作及现象________________________尾气可采用________溶液吸收。
【答案】分液漏斗 ![]() 溴水褪色 b
溴水褪色 b ![]() a 品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色 NaOH
a 品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色 NaOH
【解析】
浓硫酸与亚硫酸钠反应会生成二氧化硫,其化学方程式为:![]() ;二氧化硫能是溴水褪色,其实质是与溴水发生反应,化学方程式为:SO2+Br2+2H2O=2HBr+H2SO4,B装置的实验操作体现了二氧化硫的还原性;二氧化硫与硫化氢反应,其化学方程式为:
;二氧化硫能是溴水褪色,其实质是与溴水发生反应,化学方程式为:SO2+Br2+2H2O=2HBr+H2SO4,B装置的实验操作体现了二氧化硫的还原性;二氧化硫与硫化氢反应,其化学方程式为:![]() ,C装置体现了二氧化硫的氧化性;D装置的品红是为了验证二氧化硫的漂白性,二氧化硫能使品红溶液褪色,但加热后溶液又恢复红色,则证明二氧化硫与品红的作用具有可逆性,二氧化硫有毒,需用碱性溶液进行尾气处理,据此分析作答。
,C装置体现了二氧化硫的氧化性;D装置的品红是为了验证二氧化硫的漂白性,二氧化硫能使品红溶液褪色,但加热后溶液又恢复红色,则证明二氧化硫与品红的作用具有可逆性,二氧化硫有毒,需用碱性溶液进行尾气处理,据此分析作答。
根据上述分析可知,
(1)根据反应的原理和实验的需要,装置A中盛放浓硫酸的为分液漏斗,A为二氧化硫的发生装置,涉及的化学方程式为:![]() ,故答案为:分液漏斗;
,故答案为:分液漏斗;![]() ;
;
(2)装置B中二氧化硫与溴水会发生氧化还原反应,而使溴水褪色,其化学方程式为:SO2+Br2+2H2O=2HBr+H2SO4,S元素的化合价由+4价升高到+6价,被氧化,体现了二氧化硫的还原性,b项正确;二氧化硫与硫化氢的反应方程式为:![]() ,二氧化硫中S元素+4价被还原成0价的硫单质,被还原,表现为氧化性,c项正确;,故答案为:溴水褪色;b;
,二氧化硫中S元素+4价被还原成0价的硫单质,被还原,表现为氧化性,c项正确;,故答案为:溴水褪色;b;![]() ;c;
;c;
(3)二氧化硫具有漂白性,能使品红溶液褪色,但加热褪色后的品红溶液,溶液的颜色能复原;二氧化硫为酸性氧化物,可与氢氧化钠反应,故实验室进行尾气处理时选用氢氧化钠溶液吸收,故答案为:品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色;NaOH。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A. 0.5mol·L-1·min-1B. 1mol·L-1·min-1
C. 2mol·L-1·min-1D. 3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
B. 25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O![]() H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C. 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
D. 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为阴极:产生无色气体;阳极:有白色胶状沉淀生成且逐渐增多;U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
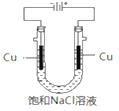
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 饱和氯水中:Cl-、![]() 、Na+、
、Na+、![]()
B. c(H+)=1.0×10-13mol·L-1溶液中:K+、![]() 、Br-
、Br-
C. Na2S溶液中: ![]() 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
D. pH=12的溶液中: ![]() 、I-、Na+、Al3+
、I-、Na+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K(25℃)下,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述正确的是
已知:(1)在科学计数法中,为了使公式简便,可以用带“E”的格式表示,例如:1E-4=1×10-4。
(2)298K(25℃)下H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。
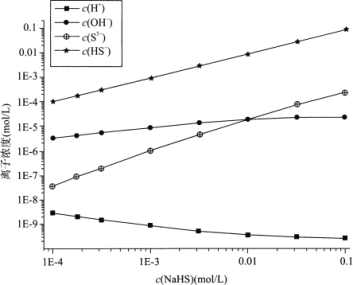
A. 0.10mol/LNaHS溶液:c(Na+)>c(HS-)>c(OH-)>c(S2-)
B. Na2S溶液中:c(OH-)-c(H+)=c(H2S)+c(HS-)
C. 当c(OH-)=c(S2-)时,c(HS-)=9.09×10-3
D. 室温下用NaOH溶液滴定NaHS溶液,滴定终点刚好形成0.1mol/LNa2S溶液,该过程可选择酚酞作指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com