
【题目】298K(25℃)下,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述正确的是
已知:(1)在科学计数法中,为了使公式简便,可以用带“E”的格式表示,例如:1E-4=1×10-4。
(2)298K(25℃)下H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。
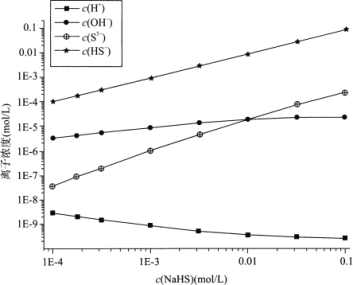
A. 0.10mol/LNaHS溶液:c(Na+)>c(HS-)>c(OH-)>c(S2-)
B. Na2S溶液中:c(OH-)-c(H+)=c(H2S)+c(HS-)
C. 当c(OH-)=c(S2-)时,c(HS-)=9.09×10-3
D. 室温下用NaOH溶液滴定NaHS溶液,滴定终点刚好形成0.1mol/LNa2S溶液,该过程可选择酚酞作指示剂
【答案】C
【解析】
A.根据电荷守恒可知,溶液中存在阴离子为S2-、HS-、OH-,阳离子为H+、Na+,阳离子所带电荷总数等于阴离子所带电荷总数;
B.硫化钠溶液中水电离的氢离子与氢氧根离子相等,即质子守恒,根据质子守恒进行判断;
C、当c(OH-)=c(S2-)时,图象分析可知为0.01mol/LNa2S溶液,根据Ka2=![]() 进行计算;
进行计算;
D. 滴定终点刚好形成0.1mol/LNa2S溶液,则滴定前NaHS溶液浓度约为0.05mol/L,滴定前后溶液均为碱性,不能选择酚酞作指示剂。
A.根据电荷守恒可知,c(H+)+c(Na+)=2c(S2-)+c(HS-)+c(OH-),选项A错误;
B.根据硫化钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),选项B错误;
C、当c(OH-)=c(S2-)时,图象分析可知为0.01mol/LNa2S溶液,根据Ka2=![]() 可得c(HS-)=
可得c(HS-)=![]() =
=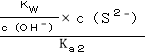 =
=![]() =9.09×10-3,选项C正确;
=9.09×10-3,选项C正确;
D. 滴定终点刚好形成0.1mol/LNa2S溶液,则滴定前NaHS溶液浓度约为0.05mol/L,滴定前后溶液均为碱性,不能选择酚酞作指示剂,选项D错误。
答案选C。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】利用金属活动性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A. 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
B. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
C. Fe+CuSO4 =FeSO4+Cu
D. 2NaCl(水溶液)![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究![]() 的性质,某同学按如图所示的装置进行实验。
的性质,某同学按如图所示的装置进行实验。

完成下列填空:
(1)装置A中盛放浓碱酸的仪器名称是________________,A中发生反应的化学方程式是___________________。
(2)装置B中的现象是________________________,说明![]() 具有________(填代码);装置C中发生反应的化学方程式是________________________________,说明
具有________(填代码);装置C中发生反应的化学方程式是________________________________,说明![]() 具有________(填代码)。
具有________(填代码)。
a.氧化性 b.还原性 c.漂白性 d.酸性
(3)装置D的目的是探究![]() 与品红作用的可逆性,写出实验操作及现象________________________尾气可采用________溶液吸收。
与品红作用的可逆性,写出实验操作及现象________________________尾气可采用________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:

已知生成氢氧化物沉淀的pH如下表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 3.4 | 6.3 | 1.5 |
完全沉淀 | 4.7 | 8.3 | 2.8 |
回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅱ是_______________、_________________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的方法______________________________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为:__________。
(5)调节pH=3的目的是_______________________ ,滤渣2含有的物质是______。
II.(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+) =_________ (保留三位有效数字)。[已知Ksp(PbS)=3.4×10-28,
Ksp(CuS)=1.3×10-36]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三氯化铁的熔点为306 ℃,沸点为315 ℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
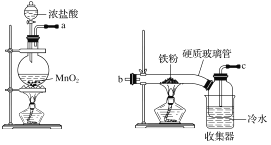
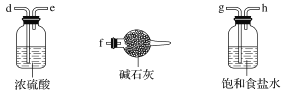
(1)装置的连接顺序为a→_____________________。
(2)饱和食盐水的作用是________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
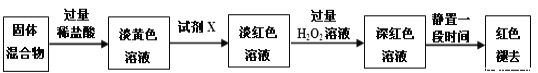
①淡黄色溶液中加入试剂X生成淡红色溶液的离子方程式为_____________。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是_________________。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明______________________________________________;
实验②的目的是___________________________;
得出结论:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对污水处理的化学方法及其原理的描述错误的是( )
A. 明矾放入污水中就会发生反应: Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B. 用氢氧化钙来中和钢铁厂、电镀厂产生的酸性废水,用硫酸或CO2中和碱性废水
C. 利用沉淀反应是除去水中重金属离子常用的方法
D. 处理含有重金属离子的废水一定不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下:![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl 
已知:氯苯为无色液体,沸点132.2 ℃。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是______。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60 ℃为宜,温度过高会生成二氯苯。
①对C加热的方法是________(填字母)。
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、________和________。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:_____________、__________(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是________。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg·t-1) | 13 | 24.9 | 51.3 | 89.2 |
则1 t苯可制得成品为________t(只要求列式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是

A. CaCO3(s)![]() Ca2+(aq)+ CO32-(aq) ΔH<0
Ca2+(aq)+ CO32-(aq) ΔH<0
B. a、b、c、d四点对应的溶度积Ksp相等
C. 温度不变,蒸发水,可使溶液由a点变到c点
D. 25 ℃时,CaCO3的Ksp=2.8×10-9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com