
| A、Cl-呈黄绿色 |
| B、Cl-有毒 |
| C、Cl-具有17个电子 |
| D、Cl-是稳定结构 |
科目:高中化学 来源: 题型:
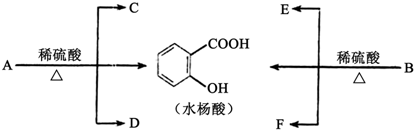
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从HCl、HBr到HI的熔点沸点升高与范德华力大小有关 |
B、CO的一种等电子体为NO+,它的电子式为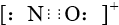 |
| C、H2O的熔点沸点大于H2S,是由于H2O分子之间存在氢键这种化学键 |
| D、电子层序数越大,s原子轨道的形状相同、半径越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③⑤ |
| C、②③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
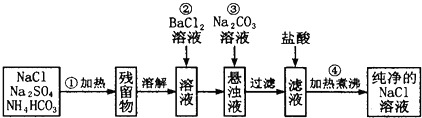
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4=2H++S6++4O2- |
| B、AlCl3=Al3++Cl3- |
| C、Ba(OH)2=Ba2++2OH- |
| D、Na2CO3=Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然物质都是绿色无毒的物质 |
| B、只饮用纯净水有益人体健康 |
| C、微量元素只能通过保健品摄入 |
| D、植物油和动物脂肪要搭配食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com